有关短周期元素X、Y、Z、M、N的信息如下:
| 元素 |
有关信息 |
| X |
X元素的原子最外层电子数是电子层数的3倍 |
| Y |
Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素 |
| Z |
Z元素的单质在X元素的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| M |
M元素的最高价氧化物对应的水化物能与M元素的最简单气态氢化物反应生成盐R |
| N |
N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)Z元素在第____ 周期第 族。
(2)Y元素的简单阴离子结构示意图为 ,Y与Z元素的气态氢化物稳定性顺序为____>(写化学式)。
(3)化合物N2X2与CO2反应的化学方程式为 。
(4)盐R中含有的化学键类型有 。盐R的水溶液显酸性,用离子方程式表示其盐溶液显酸性的原因为 。
(5)电解盐NY水溶液的化学方程式为 。
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1。请回答下列问题: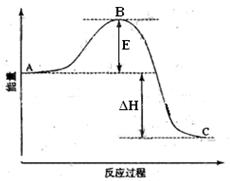
(1)图中E的大小对该反应的反应热有无影响?
▲。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ▲。
(2)已知单质硫16g燃烧放热为149 kJ写出硫燃烧热的热化学方程式: ▲。
(3)计算由S(s)生成3 molSO3(g)的△H ▲。
已知2X2(g)+Y2(g) 2Z(g),△H=-a kJ•mol-1(a>0),在一个容积固定的容器中加入2molX2和1molY2,在500℃时充分反应达平衡后Z的浓度为W mol•L-1,放出热量b kJ。
2Z(g),△H=-a kJ•mol-1(a>0),在一个容积固定的容器中加入2molX2和1molY2,在500℃时充分反应达平衡后Z的浓度为W mol•L-1,放出热量b kJ。
(1)此反应平衡常数表达式为 ▲;若将温度降低到300℃,则反应平衡常数将 ▲(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度
▲Wmol•L-1(填“>”、“<”或“=”),a、b、c之间满足关系 ▲(用代数式表示)。
(3)能说明反应已达平衡状态的是 ▲。
| A.浓度c(Z)=2c(Y2) | B.容器内压强保持不变 |
| C.v逆(X2)=2v正(Y2) | D.容器内的密度保持不变 |
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将 ▲(填“变大”、“变小”或“不变”)。
如下图所示,若电解5min时铜电极质量增加2.16g, 试回答:
试回答:
(1)电源电极x名称为 ▲。
(2)pH变化:B ▲,C ▲。(填“增大”“减小”或“不变”)。
(3)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为 ▲(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是 ▲(设电解前后溶液体积无变化)。
(15分)肉桂酸甲酯(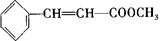 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(!)关于肉桂酸甲酯属类的说法,正确的是:
a.芳香烃 b.烯烃 c.芳香酸 d.芳香醛 e.芳香醇 f,芳香酯
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键)。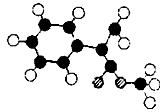
G的结构简式为。
(3)用芳香烃A为原料合成G的路线如下: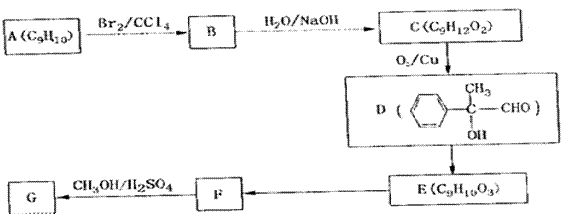
①化合物E中的官能团有(填名称)。
②F  G的反应类型是,该反应的化学方程式为。
G的反应类型是,该反应的化学方程式为。
(10分)根据图示填空:
(1) 化合物A的分子式为C4H4O3, 则A含有的官能团的名称是
化合物A的分子式为C4H4O3, 则A含有的官能团的名称是
(2)1molA 能与2mol H2反应生成1mol E ,其反应方程式是
(3)与A具有相同官能团的A的同分异构体的结构简式为
(4)F的结构简式是。