碱式碳酸锌【xZnCO3·yZn(OH) 2·zH2O】主要用做橡胶硫化促进剂,工业上利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程如下:
请回答下列问题:
(1)向锌焙砂加入足量稀硫酸进行酸溶的过程中,所发生反应的离子方程式为 、___ _(写其中任意两个)。
(2)从滤渣I中分离出SiO2的部分流程如下:
①试剂X的名称为____ 。②操作1的方法为________ 。
(3)加入锌粉的目的是____ ,从滤渣Ⅱ中获取铜的操作方法为 。
(4)高温煅烧碱式碳酸锌得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L,则该碱式碳酸锌的化学式为 。
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是价,Na2FeO4具有较强的(填“氧化性”或“还原性”)。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是(用离子方程式表示)。
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 + 10NaOH + 3NaClO = 2+ 5+ 9。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4 。
① 若电解所需的浓NaOH溶液为16 mol/L,则在实验室配制500 mL该浓度的溶液需NaOHg,配制过程所需玻璃仪器是。
② 电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示: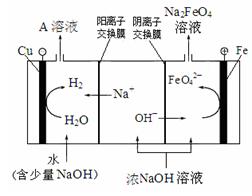
阳极的电极反应式是;可循环使用的物质是,理由是。
电解铝厂的实验室为测定铝土矿(主要成分是Al2O3,杂质是Fe2O3 、SiO2)样品中Al2O3的质量分数,操作如下:
Ⅰ.将铝土矿样品粉碎后加入足量稀H2SO4溶液,充分反应后过滤,得滤液a
Ⅱ.向滤液a中加入足量NaOH溶液,充分反应后过滤,得滤液b
Ⅲ.向滤液b中通入足量CO2,充分反应后过滤、洗涤,得Al(OH)3沉淀
Ⅳ.……
(1)滤液a中阳离子有(写离子符号)。
(2)操作Ⅱ中反应的离子方程式是。
(3)操作Ⅳ是。
(4)要测定铝土矿样品中Al2O3的质量分数,所需数据是(质量数据用x、y…表示,单位是g);铝土矿样品中Al2O3质量分数表达式是(用含x、y…的式子表示)。
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g) CH3OH(g) △H="a" kJ/mol
CH3OH(g) △H="a" kJ/mol
为研究平衡时CO的转化率与反应物投料比( )及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图:
)及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图:
(1)反应热a 0 (填“>”或“<”),判断依据是。
(2)若其它条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
①投料比:ⅠⅡ (填“>”或“<”)。
②若Ⅱ反应的n(CO)起始 ="10" mol、投料比为0.5,
A点的平衡常数KA=,
B点的平衡常数KBKA (填“>”或“<”或“=”)。
(3)为提高CO转化率可采取的措施是(至少答出两条)。
制作软质隐形眼镜高分子材料(M)和聚酯PET的合成路线如下:
已知酯与醇可发生如下酯交换反应:
(R、R′、R″代表有机基团)
(1)A的相对分子质量是28,A、B分子中含有的官能团分别是。
(2)B的名称是。
(3)反应I的反应类型是_______(选填字母)。
a.加聚反应b.缩聚反应
(4)有关B、C、D的说法正确的是。
a.1mol B最多可以和1 mol C反应
b.C、D都能使Br2的CCl4溶液褪色
c.D与NaOH溶液共热后可以得到B和C
(5)B→D的化学方程式是。
(6)C有多种同分异构体,其中一种是合成纤维维尼纶的单体,该分子在酸性环境下水解得到两种产物,它们的相对分子质量相差16,该同分异构体的结构简式是。
(7)反应II的化学方程式是。
(1)已知:
甲醇制烯烃反应①:2CH3OH(g)=C2H4 (g)+2H2O(g)△H1=-29.0 KJ·mol-1
甲醇脱水反应②:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H2=-24.0 KJ·mol-1
乙醇异构化反应③:CH3CH2OH(g)=CH3OCH3(g))△H3=+50.8 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
(2)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ、通入氨,冷却、加食盐,过滤;Ⅱ、不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是。而方法Ⅱ的优点是其滤液可以。
(3)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式,电解液中加入Cu(NO3)2的原因是。