(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1 >E2,则该反应为 (填“吸热”或“放热”)反应。
②已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=Q1kJ·mol-1
2CO2(g)+H2 (g)=C2H2(g)+2O2(g) △H2=Q2kJ·mol-1。根据盖斯定律,计算此时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变为 kJ·mol-1(用含有Q1和Q2的式子表示)。
(1)用5.0 mol·L-1的NaOH溶液配制0.1mol·L-1的NaOH溶液时,下图所示的仪器中,肯定不需要的是________(填序号),配制上述溶液还需要的玻璃仪器是________________________________________________(填仪器名称).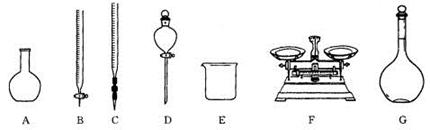
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)________.
①准确取出的浓NaOH溶液在空气中露置时间过长;②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;④稀释NaOH溶液的仪器未洗涤.
某温度时,在2 L容器中X、Y、Z三种物质随时间的变化曲线如图所示: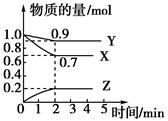
(1)由图中的数据分析,该反应的化学方程式为__________________________。
(2)反应开始至2 min时Z的平均反应速率为____________。
乙烯和苯是两种重要的化工原料,现有同学分别取这两种物质进行实验:
| 实验步骤 |
实验现象 |
解释及相关反应方程式 |
| 将乙烯通入溴水中 |
发生了反应(填反应类型),反应方程式: |
|
| 将苯与溴水混合振荡,静置 |
溴在苯中的溶解度比在水中的溶解度;苯的密度比水。 (填“大”或“小”) |
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为。
(2)B中各电极的电极反应式:负极:;正极: 。
(3)C中被腐蚀的金属是,正极反应。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是。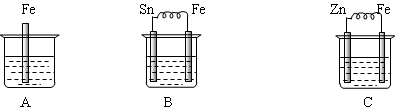
(教材变式题)对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编号 |
改变的条件 |
化学反应速率 |
| ① |
降低温度 |
|
| ② |
增大O2的浓度 |
|
| ③ |
使用V2O5作催化剂 |
|
| ④ |
压缩体积 |
