I、实验室制备、收集干燥的SO2,所需仪器如下图。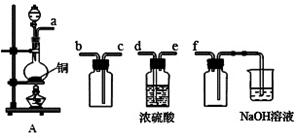
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
(2)验证产生的气体是SO2的方法及实验现象是____。
II、SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示: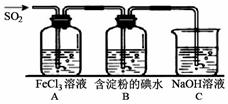
(1)装置A中的现象是_____。写出B中发生反应的离子方程式_____。
(2)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有 。
a.酒精灯
b.烧瓶
c.漏斗
d.烧杯
e.玻璃棒
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。上述方案中不合理的是_____。
(4)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1 g FeS2产生7.1 kJ热量,写出煅烧FeS2的热化学反应方程式_____。
(15分)利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O]。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,主要实验步骤如下: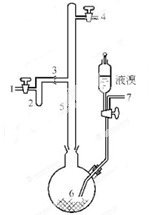
步骤l:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2:从导管口7导入氮气,同时打开导管口l和4放空,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管。
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4:加热烧瓶6,回流一定时间。
步骤5:将氮气的流动方向改为从导管口4到导管口l。将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2。
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)步骤l中,铝箔用CCl4浸泡的目的是 。
(2)步骤2操作中,通氮气的目的是 。
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 。
(4)步骤4依据何种现象判断可以停止回流操作 。
(5)步骤5需打开导管口l和4,并从4通入N2的目的是 。
II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示。
实验中可选用的试剂:①处理过的铝箔;②2.0 mol•L-1硫酸;③2.0mol•L-1NaOH溶液。
(6)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol•L-1NaOH溶液,加热至不再产生气泡为止。
②过滤。
③ 。
④过滤、洗涤。
⑤ 。
⑥蒸发浓缩。
⑦冷却结晶。
⑧过滤、洗涤、干燥。
【改编】有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下: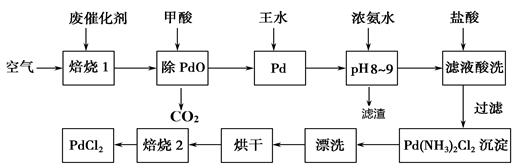
(1)“焙烧1”的目的是 。
(2)写出甲酸[HCOOH]与PdO反应的化学方程式 。
(3)在“调pH为8—9”是为除去铁元素,滤渣成分为 ;写出除铁的离子方程式为 。
(4)加入浓盐酸酸洗的目的是 。
(5)写出证明“焙烧2”中固体已分解完全的实验操作: 。
甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①请指出该装置的不足之处 、 。
②Cl2与Na2SO3溶液反应的离子方程式为 。
③设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化 。
乙组探究乙酸乙酯(沸点77.1℃)在不同温度、不同浓度NaOH溶液中的水解速率。
取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
| 实验 试剂 |
试管Ⅰ(55℃) |
试管Ⅱ(55℃) |
试管Ⅲ(55℃) |
试管Ⅳ(75℃) |
| 乙酸乙酯/mL |
1 |
V1 |
V2 |
V2 |
| 1mol·L—1NaOH/mL |
V4 |
3 |
0 |
V5 |
| 蒸馏水/mL |
0 |
V6 |
5 |
2 |
④请完成上表,其中V2 = ,V4= ,V5= 。
⑤实验中,可用饱和食盐水替代蒸馏水,其优点是 ;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是 。
⑥实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 。
【改编】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,下图表示的过滤操作中的一处错误是_______;过滤后的沉淀需要洗涤,则实验室进行沉淀洗涤的操作是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,检验滤液中不存在Fe3+的实验操作是_____________。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阴极的电极反应式 。
(5)下列各组试剂中,不能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)。高锰酸钾与硫酸锰反应制备MnO2的离子方程式为_____________。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置还可采取的改进措施是_____________________________。