钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下: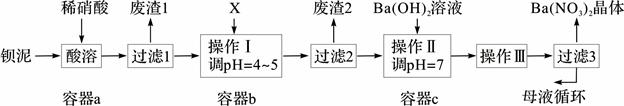
已知:i Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Cu+的最外层核外电子排布式为_________。
(2)研究者预想合成一个纯粹由氮组成的新物种N5+N3-,若N5+中每个氮原子均满足8电子结构,以下有关N5+推测正确的是。
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3。通过3CH4 +2(HB=NH)3+6H2O ==3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有_________个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为_________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。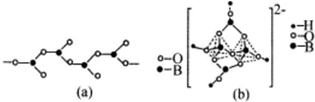
(5) NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为_________(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_________g(氧离子的半径为1. 40×10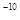 m,
m, ≈l. 732)。
≈l. 732)。
(有机化学基础选做题,共9分)
(1)写出葡萄糖发生银镜反应的化学方程式___________________。
(2)某有机物含C、H、O三种元素,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,且烃基与羟基上氢原子个数之比为2:1,它的相对分子质量为62,则该有机物的结构简式为__________。
(3)向苯酚钠溶液中通入少量的CO2 ,溶液将变浑浊,请写出反应的化学方程式_____________。
(4)某有机物的结构简式如图, 则此有机物可发生的反应类型有______(填字母)
则此有机物可发生的反应类型有______(填字母)
①取代反应②加聚反应③消去反应④酯化反应⑤水解反应⑥氧化反应⑦显色反应
A.①②④⑥⑦B.②③④⑥⑦C.①②③④⑤⑥D.全部
(物质结构与性质选做题,共9分)碳、氮、氧的单质及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为_____________。
(2)碳、氮、氧原子第一电离能由大到小的顺序是: _________________。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子。
(4)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:__________。
(5)写出CO分子的一种等电子体的分子式__________。
(本题共12分)硫及氯的化合物在生产及生活中有着广泛的应用。
(1)SO2和Cl2均可作漂白剂,但将它们按物质的量1:1通入水中,却没有漂白性,原因是_________(写出反应的离子方程式)。
(2)工业上常用电解法制Cl2,写出反应的化学方程式_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
| A.氨水 | B.稀盐酸 | C.硝酸钾溶液 | D.氯水 |
(4)将22.4L(标准状况)的SO2气体通入1L1 mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______________。
(5)在25 ℃时,向0.1 L 0.002 mol·L-1的NaCl溶液中逐滴加入0.1 L 0.002 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中继续加入0.1 L 0.002 mol·L-1的NaI溶液,看到的现象是________,产生该现象的原因是_____________(用离子方程式表示)。(已知:25 ℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法___________________(填序号)。
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。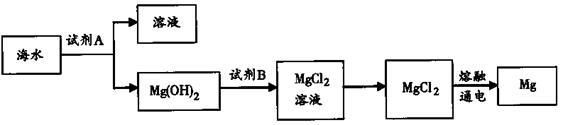
①试剂B是________(填化学式)。
②由无水MgCl2制取Mg的化学方程式是________________________。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示: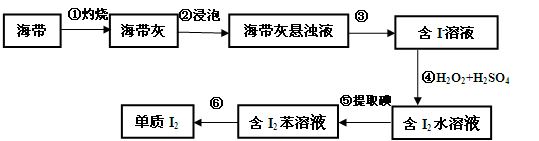
I:下列不属于步骤①操作所用的仪器是 ________(填序号)。
A.酒精灯 B.漏斗C.坩埚 D.泥三角
II:步骤③的实验操作名称是__________。
III:④步骤反应的离子方程式________。
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法。