回答下列问题
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)____ c(CH3COO-)(“>”、“=”或“<”)。
(2)将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是 。
(3)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)
4C(g)  H >0 达到平衡时,c(A)=2mol/L,c(B)=7mol/L,,c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ,若改变条件重新达到平衡后体系中C的质量分数增大,其采取的措施是 。
H >0 达到平衡时,c(A)=2mol/L,c(B)=7mol/L,,c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ,若改变条件重新达到平衡后体系中C的质量分数增大,其采取的措施是 。
(4)以丙烷为燃料制作新型燃料电池,电池的一极通入O2和CO2,另一极通入丙烷,电解质是熔融碳酸盐。电池负极的电极反应式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
(5)拆开lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946 kJ,则1mol H2生成NH3的反应热为 。
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的。图中M(C3H4O)和A均能发生银镜反应。N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种。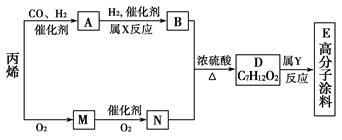
试写出:
(1)下列物质的结构简式:
A________;M________;E________。
(2)物质A的同类别的同分异构体的结构简式为______________。
(3)反应类型:X______________;Y__________________。
(4)写出D→E的化学方程式:____________________。
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝: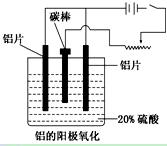
2Al2O3 4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材B.石墨 C.铅板D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
光纤预制棒是光缆生产的最“源头”项目,目前国内光缆生产厂家约200家,大部分靠买进口光纤预制棒来生产光缆。
(1)光纤预制棒跟光导纤维的成分相同,那么光纤预制棒的化学成分是。
(2)如果把光缆裸露在碱性土壤中,结果会短路,用离子方程式说明原因。
(3)下列说法正确的是。
| A.石英与普通玻璃都是硅酸盐制品 |
| B.二氧化硅是良好的半导体材料 |
| C.工艺师用盐酸刻蚀石英制作艺术品 |
| D.石英与二氧化碳中的化学键相同 |
(4)石英可以制备各种各样的陶瓷制品,如坩埚、蒸发皿、氮化硅高温结构陶瓷等。写出氮化硅的化学式,工业上用石英、焦炭、氮气在高温条件下制备氮化硅,写出反应的化学方程式。
(1)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,则该复合材料的基体和增强体材料分别可能是( )
| A.金属;碳纤维 |
| B.陶瓷;SiO2 |
| C.合成树脂;SiO2、Al2O3、Na2O |
| D.合成树脂;碳纤维 |
(2)石黑炸弹也叫断电炸弹、轻炸弹,专用于破坏敌方的电力设施。这种炸弹爆炸后会喷散出大量经化学方法制成的石墨丝(碳纤维),其直径仅有几千分之一英寸。这种石墨丝非常轻,在目标上空可飘浮较长一段时间,形成较大范围的“碳纤维云”,它们粘上电力设施时,即会破坏电力系统。简述石墨炸弹能够破坏电力系统的原因:
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
(1)写出化学式A,D,F,G属于晶体;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式、。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。