(1)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,则该复合材料的基体和增强体材料分别可能是( )
| A.金属;碳纤维 |
| B.陶瓷;SiO2 |
| C.合成树脂;SiO2、Al2O3、Na2O |
| D.合成树脂;碳纤维 |
(2)石黑炸弹也叫断电炸弹、轻炸弹,专用于破坏敌方的电力设施。这种炸弹爆炸后会喷散出大量经化学方法制成的石墨丝(碳纤维),其直径仅有几千分之一英寸。这种石墨丝非常轻,在目标上空可飘浮较长一段时间,形成较大范围的“碳纤维云”,它们粘上电力设施时,即会破坏电力系统。简述石墨炸弹能够破坏电力系统的原因:
有如下有机物:(每空一分)
① ②
② ③
③
④CH3CH=CHCH3⑤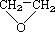 ⑥
⑥ ⑦
⑦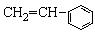
(1)互为同分异构体的是:__________,存在手性异构体的是:____________,存在顺反异构体的是__________,互为同系物的是(任写一对):__________;
(2)氢核磁共振(1H-NMR)图谱如上图所示的有_______________________________;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量 完全相同的烃是:__________________________;
完全相同的烃是:__________________________;
(4)有机物④的系统命名法名称是____________________________________;
(5)有机物⑤的键线式_____________,其分子中碳原子_______杂化。
(12分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ________ B __________ C __________ D ___________
(2)写出A元素在周期表中的位置,第_________周期,第_______族。
(3)C 单质在高温下与B单质充分反应的化学方程式为 ____________。
(4)用电子式表示化合物 C2D 的形成过程 _______________________________.
(5)一般情况下,氢元素与D元素形成的化合物是以____键(填极性或非极性)结合的 化合物。(填“共价”或“离子”)
在下列有机物中:①CH3CH3②CH2=CH2③正丁烷④C2H6 ⑤异丁烷⑥CH3CH=CH2中,互为同系物的是 ,互为同分异构体的是,为同一种物质的是(填编号)
,互为同分异构体的是,为同一种物质的是(填编号)
用锌棒、石墨和CuCl2溶液组成的原电池,锌棒为___极,电极反应式为_________,石墨为___极,电极反应式为______,原电池反应的离子方程式为___________。
已知乙烯能发生以下转化关系: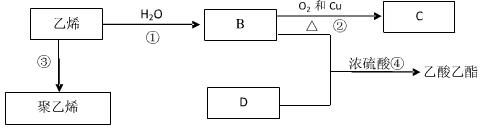
|
试回答下列问题:
(1)写出②、④反应的化学方程式及 反应类型:
反应类型:
②: 反应类型:
④: 反应类型:  (2)乙烯和其它物质发生加成反应,不能得到的是 (填标号)。
(2)乙烯和其它物质发生加成反应,不能得到的是 (填标号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |