某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度(保留四位小数) mol/L
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”)。
(3)他们记录的实验数据如下:已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18kJ·℃-1· kg-1,各物质的密度均为1g·cm-3。①计算完成下表。(保留小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将(填“变大”或“变小”或“无影响”)。
(8分)某学生设计了如下实验:
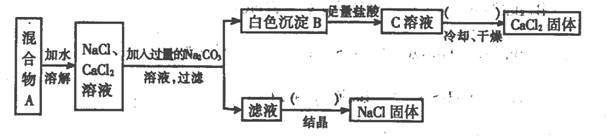 |
回答下列问题:
(1)该同学的实验目的是;
(2)上图括号内的操作均为;
(3)按此实验方案得到的NaCl固体中肯定含有杂质(填化学式);为了解决这个问题可以向过滤得到的滤液中加入适量的;
下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现欲用该浓硫酸配制成1mol/L的稀硫酸。
现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中。
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与
刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
(4)下列操作中,容量瓶所不具备的功能有。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(5)某同学用固体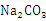 配制500ml 0.1mol·L-1
配制500ml 0.1mol·L-1 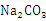 溶液的过程如下图所示:
溶液的过程如下图所示: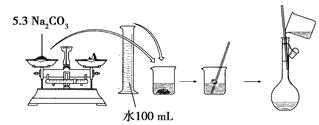
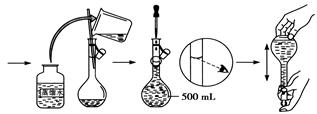
你认为该同学的错误步骤有。
A.1处 B.2处 C.3处 D.4处
把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下:
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将沿烧杯内壁慢慢注入盛有少量的烧杯中; |
E.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入mL的容量瓶中;
G.改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线cm处。
(1)填写上述步骤中的空白:
C;D;F;H。
(2)请按正确的操作步骤进行排序。
(3)试分析下列操作会使所配溶液的浓度与2.00 mol·L-1相比(填偏大、偏小或不变)?
①若在操作中没有把洗涤烧杯和玻璃棒的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度。
②若容量瓶未干燥即用来配制溶液,。
③若定容时俯视刻度线,会使稀硫酸溶液的浓度。
(19分)实验室欲用胆矾配制250 mL0.2 mol·L-1的CuSO4溶液。
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A计算 B 称量 C.溶解 D. E. F. 定容 G. 摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒还有______和(填仪器名称)
(3)经计算需要称取CuSO4·5H2O的质量为。
(4)若称取胆矾时砝码被放在左盘(10g以下用游码),则配制的CuSO4溶液的浓度(填“偏高”、“偏低”、“无影响”);若定容时仰视刻度线,则配制的CuSO4溶液的浓度(填“偏高”、“偏低”、“无影响”)。
(5)从准确配制好的CuSO4溶液中取出50mL ,则这50mL CuSO4溶液的物质的量浓度为______________,所含Cu2+的质量为。