甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①请指出该装置的不足之处 、 。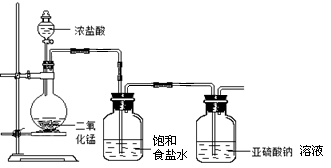
②Cl2与Na2SO3溶液反应的离子方程式为 。
③设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化 。
乙组探究乙酸乙酯(沸点77.1℃)在不同温度、不同浓度NaOH溶液中的水解速率。
取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
④请完成上表,其中V2 = ,V4 = ,V5 = 。
⑤实验中,可用饱和食盐水替代蒸馏水,其优点是 ;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是 。
⑥实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 。
本世纪,人类社会将逐渐步入氢经济时代。目前大规模产氢方式仍是化学制氢。
I、催化重整制氢
以甲醇为例,反应制氢气的一般途径有:
CH3OH(l)=2H2(g)+CO(g)△H1=+128 kJ·mol-1
CH3OH(l)+H2O(l)=3H2(g)+CO2(g)△H2=" a" kJ·mol-1
已知:H2(g)+1/2O2(g)=H2O(l)△H=-286 kJ·mol-1
为求得△H2,还要知道的燃烧热,若其燃烧热为△H=一283 kJ·mol-1,则△H2=。
Ⅱ、金属置换制氢
(1)研究表明,刚切割的金属表面具有很高的反应活性。当铝或铝合金在水中被切割或碾碎的时候,可以持续地释放出氢气。使用铝与水反应制氢气比使用其它活泼金属与水反应制氢气的优点有:①价廉,成本较低;②。
(2)利用天然气重整得到的CO、H2混合气对金属氧化物进行还原,然后将金属与水反应放出氢气,由此达成一个良性循环。根据高中所学的知识合理预测该金属单质,并写出该金属在加热的条件下与水蒸汽反应的化学方程式。
III、太阳能制氢
利用光能分解水必须要有催化剂的参与。下列有关催化剂的说法正确的是
| A.使用高效催化剂分解水制得H2的同时还可以获得能量 |
| B.使用高效催化剂后常温下水可以自发分解 |
| C.硅胶具有多孔结构,有较大的表面积,常用做催化剂的载体 |
| D.对于可逆反应,催化剂在增大正反应速率的同时也增大逆反应速率 |
Ⅳ、配位氢化物制氢
在硼氢化钠(NaBH4)水溶液中加入特定催化剂后,可以迅速地发生水解反应生成偏硼酸钠和氢气。请写出此水解反应的化学方程式。
将无水偏硼酸钠、氢化镁(MgH2)放入球磨设备中,通入氩气或氢气并保持压强100~500 kPa研磨0.5~4 h,即可得到硼氢化钠。研磨过程中需要通入氩气或氢气并保持压强100~500 kPa的目的是。
近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其部分流程如下: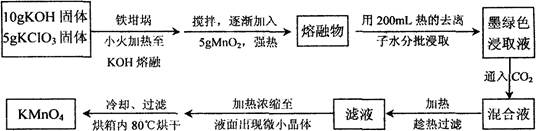
(1)实验中采用铁坩埚而不用瓷坩埚的原因是;
(2)KOH、KClO3、MnO2共熔制得绿色K2MnO4的化学方程式;
(3)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,则K2MnO4完成反应时,转化为KMnO4的百分率约(精确至0.1%)
(4)若通入CO2太多,则在加热浓缩时,会有晶体和KMnO4晶体一起析出。
(5)在加热、浓缩、烘干的过程中温度不宜过高,其原因是;加热时用玻璃棒不停搅拌溶液的目的是。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内 含物质)组装成实验装置:
含物质)组装成实验装置: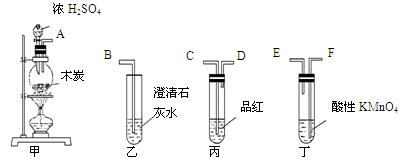
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接,接,接;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____,丙中 ______;
(3)丁中酸性KMnO4溶液的作用是;
(4)写出甲中反应的化学方程式 ______。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2 O
O NH4HCO3; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3
Na2CO3 +CO2↑+H2O
+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是(填字母标号);
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小, 所以在溶液中首先结晶析出
所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制 碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题: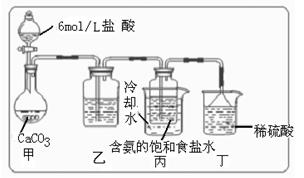
 (Ⅰ)乙装置中的试剂是
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
(IV)请你再写出一种实验室制取少量碳酸氢钠的方法:。
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为_________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: ________________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为(请写出计算过程)
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl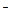 、OH
、OH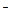 和SO
和SO
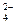 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO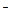 ;假设3:SO32-、ClO
;假设3:SO32-、ClO 都存在。
都存在。
设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI
L-1KMnO4、淀粉-KI 溶液、紫色石蕊试液.
溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
 步骤1:取少量吸收液于试管中,滴加3 moL 步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
|
| 步骤2:在A试管中滴加紫色石蕊试液 |
|
步骤3:在B试管中滴加0.01mol L-1KMnO4 L-1KMnO4 |