【化学-有机化学基础】(13分)某科研小组通过以下路线合成某种药物F:

已知:
①已知同一个碳原子上连有两个羟基是不稳定的,易失去水形成羰基;
②A、B核磁共振氢谱表明分子中均有4种化学环境的氢,峰面积之比分别为1:2:2:1、2:2:2:1;
③ 。
。
(1)下列关于D的说法正确的是 (填序号)。
a.属于芳香族化合物 b.既能与金属钠反应也能与氢氧化钠反应
c.属于苯酚的同系物 d.D在一定条件下也能转化为C
(2)C的分子中的官能团名称为_______________。F的结构简式为_______________。
(3)检验B分子中官能团的化学试剂为_______________________。
(4)生成A的化学方程式为__________,反应类型是__________。
(5)E有多种同分异构体,其中符合下列条件的同分异构体有_____种。
①其水溶液遇FeCl3溶液呈紫色;②属于酯类;③能发生银镜反应
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: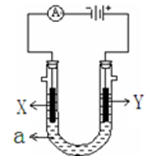
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是。
②电解NaCl溶液的离子方程式是。
③将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为。
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为,工作一段时间后pH将___________(填“增大”或 “减小”或“不变”) 。
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是______________。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是。
(2)“③”中调节pH至4.7,目的是。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+  Cr(OH)3。绿矾还原CrO42-的离子方程式为:。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是Kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是Kg(保留两位小数)。
氯碱工业中电解饱和食盐水的原理示意图如下图所示: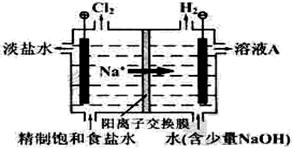
(1)溶液A的溶质是(写化学式);电解饱和食盐水的离子方程式是;
(2)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(3)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。
精制流程如下(淡盐水和溶液A来自电解池):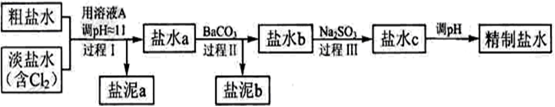
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
化合物G的合成路线如下: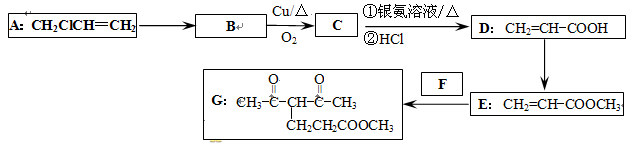
(1)D中含氧官能团的名称为,D的分子式为,1 mol D完全燃烧所需氧气为mol;
(2)写出A→B的化学反应方程式。
(3)写出C→D的化学反应方程式。
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为。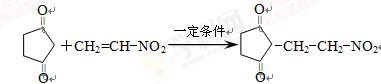
(5)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式。
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下: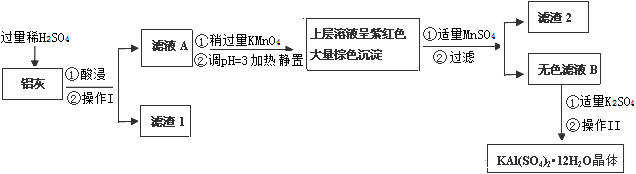
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是,操作Ⅱ是蒸发浓缩、、过滤、、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+)。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:。滤渣2含有的物质是。