甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| |
化学方程式 |
焓变△H/kJ·mol-1 |
| 甲烷氧化 |
CH4(g)+2O2(g)=CO2(g)+2H2O(g) |
△H1=-802.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) |
△H2=-322.0 |
|
| 蒸气重整 |
CH4(g)+H2O (g)=CO(g)+3H2(g) |
△H3=+206.2 |
| CH4(g)+2H2O (g)=CO2(g)+4H2(g) |
△H4=+165.0 |
(1)已知反应CO(g)+H2O(g)=CO2(g)+H2(g) △H=_______________ kJ·mol-1。
(2)反应CO(g)+H2O(g) H2(g)+CO2(g)化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一:
H2(g)+CO2(g)化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。
(3)在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mo1,则达到平衡后CO的转化率为_____。
(4)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图。
CH3OH(g) ΔH。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图。
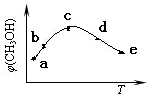
对图进行分析,从a到c段曲线变化特点看,温度升高甲醇体积分数增高的原因可能是:______________;将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有_______。
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素。已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数 是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。(注:答题应根据题目要求,用元素符号或化学式来表示对应元素或物质)
是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。(注:答题应根据题目要求,用元素符号或化学式来表示对应元素或物质)
(1)Z的离子结构示意图
(2)为了提高工业合成XQ 3产率(该反应为放热反应),下列措施合理的是
3产率(该反应为放热反应),下列措施合理的是
a.升高温度
b.加 入催化剂
入催化剂
c.将XQ3分离出去
d.增大反应体系压强
(3)WQ4与Y2反应通过下图装置可将化学能转化为电能。b电极反应式为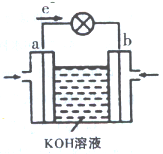
(4)标况下2.24LWY2被200mL 1 mol/LZYQ溶液吸收,所得溶液阴离子浓度从大到小的顺序是
(5)下图为某反应体系各物质(均为气体)的量及能量关系,该反应的热化学方程式为。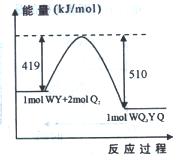
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,其化学方程式是。
食盐和工业用盐具有广泛的用途。已知,工业盐含NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业盐和食盐的是
a. H2O b.酸性高锰酸钾溶液 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为.
(3)某工厂废液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就 能使NaNO2中的氮转化为对空气无污染的气体,该物质是
能使NaNO2中的氮转化为对空气无污染的气体,该物质是
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式。
(14分)食品添加剂必须严格按照食品安全国家标准的规定使用。作为食品添加剂中的防腐剂G和W,可经下列反应路线得到(部分反应条件略)。
(1)G的制备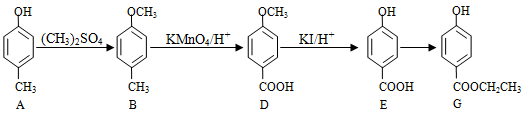
①A久置于空气中,由无色变为 有色,原因是,常温下A在水中的溶解度比苯酚的(填“大”或“小”)。
有色,原因是,常温下A在水中的溶解度比苯酚的(填“大”或“小”)。
②设计A → B和D → E的目的是。
③符合下列条件的G的同分异构体有种,
a 能与氯化铁溶液显紫色 b苯环上有对位两个取代基
c 能发生银镜反应 d 1mol物质与足量钠反应放出1molH2。
(2)W的制备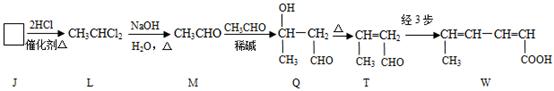
①J→L为加成反应,J的结构简式为__________。
②M→Q的反应反应类型是_________。
③检验T中含有碳碳双键官能团的实验方案是 。
。
④应用M Q
Q T的原理,由T制备W的反应步骤为
T的原理,由T制备W的反应步骤为
第1步:;第2步:消去反应;第3步:。(第1、3步用化学方程式表示)
a、b、c、d为原子序数依次增大的短周期元素,b、c、d同周期,由a、b、c、d四种元素形成的常见酸式盐A有如图所示的转化关系(图中每种字母表示一种单质或化合物)。
(1)物质C的结构式为________________。
(2)写出下列物质的化学式:F________,I________。
(3)写出反应①的化学方程式: ______________________。
(4)将F与一定量盐酸混合,二者恰好反应得到溶液M,在M中加入Na2O2时,加入Na2O2的质量与产生沉淀的质量具有如图所示关系,则p点时产生沉淀与放出气体的物质的量之比为,从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为。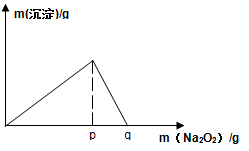
(4)将A和E组成的固体混合物X g 溶于水配成溶液,向其中慢慢滴入I的稀溶液,测得加入I溶液的体积与生成C的体积(标准状况)如下表所示。则I溶液的物质的量浓度为_____。
| I 溶液的体积(mL) |
4 |
8 |
15 |
20 |
50 |
120 |
150 |
|
| C的体积(mL) |
0 |
0 |
112 |
224 |
 896 896 |
2240 |
2240 |
下图中A~J分别代表相关反应的一种物质。已知A为NH4HCO3,分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)写出反应①②的化学方程式:
①________________________________________________________________________,
②________________________________________________________________________ 。
。
(2)写出反应③的离子方程式:__________________________________________。
(3) J与F反应的化学方程式:______________________________________________。
(4) 在反应④中,当生成标况下2.24 L G时,转移电子数为mol。