(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
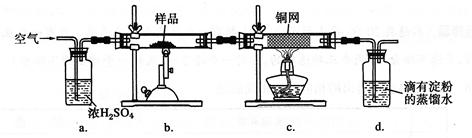

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2 + 21O2  8Cu + 4FeO + 2Fe2O3 + 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
8Cu + 4FeO + 2Fe2O3 + 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)滴定时,标准碘溶液所耗体积为 mL。用化学方程式表示滴定的原理: 。
(5)通过计算可知,该黄铜矿的纯度为 。
已知镁能在二氧化碳中燃烧,反应的化学方程式为2Mg+CO2 2MgO+C。某课外活动小组根据Mg与CO2的反应原理,探究Mg与SO2的反应及固体产物,实验装置如图所示。请回答下列问题:
2MgO+C。某课外活动小组根据Mg与CO2的反应原理,探究Mg与SO2的反应及固体产物,实验装置如图所示。请回答下列问题:
(1)装置A中发生反应的化学方程式为______________。
(2)装置B中盛装的干燥剂可以是_______(填序号)。
①浓硫酸②无水CaCl2③碱石灰④五氧化二磷
(3)实验开始时,先让A中反应进行一段时间,然后再点燃C处酒精灯,这样做的目的是_______。
(4)D装置的作用是___________,发生反应的离子方程式为______________________。
(5)甲同学认为镁与SO2反应的方程式应该是2Mg+SO2 2MgO+S;
2MgO+S;
乙同学认为硫是活泼的非金属,发生的反应应该是3Mg+SO2 2MgO+MgS;
2MgO+MgS;
而丙同学认为SO2是酸性氧化物,发生的反应应该是:2Mg+3SO2 2MgSO3+S。
2MgSO3+S。
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,且都能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量反应后所得固体样品于试管Ⅰ中 |
|
| 步骤2:向试管Ⅰ中的固体慢慢滴加__________, 试管Ⅰ口塞上带导管的单孔塞,并将导管插入盛有________的试管Ⅱ中。 |
a.若试管Ⅰ中的固体未完全溶解,且_______,则甲同学的推测是正确的。 b.若试管Ⅰ中的____________,则乙同学的推测正确。 |
根据上述实验探究,能证明丙同学推测正确的操作和预期现象是_________________。
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O实验装置图如下。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是____________。装置E中为___________溶液。
(2)装置A中发生反应的化学方程式为_______________________。
(3)①装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.酸性高锰酸钾溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液d.饱和NaHCO3溶液
②为了使SO2尽可能吸收完全,在不改变C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
(已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↑+SO2↑+H2O;供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)
已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验: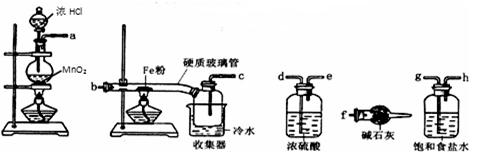
(1)装置的连接顺序为。
(2)饱和食盐水的作用是。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_____________________。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明;
实验②的目的是;
得出结论:溶液褪色的原因是。
Ⅰ.实验室制备一氧化碳原理是:HCOOH H2O+CO↑。
H2O+CO↑。
(1)从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置,并标明容器中的试剂。
(2)装置Ⅱ的作用是。
Ⅱ.实验室制备四水甲酸铜[Cu(HCOO)2·4H2O]晶体实验步骤如下:
(1)碱式碳酸铜的制备:
a、步骤ⅰ是将一定量胆矾和NaHCO3固体一起放到研钵中研磨,其目的是。
b、步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到(填写实验现象),说明温度过高。
c、相关的化学方程式是。
(2)四水甲酸铜[Cu(HCOO)2·4H2O]晶体的制备:
将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。然后蒸发,冷却,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
a、相关的化学方程式是。
b、“趁热过滤”中,必须“趁热”的原因是。
c、用乙醇洗涤晶体的目的是。
Ⅲ.探究小组用滴定法测定四水甲酸铜[Cu(HCOO)2·4H2O](Mr=226)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2- =CuY2-+2H+,写出:(1)计算Cu(HCOO)2·4H2O质量分数的表达式ω=______;
(2)下列操作会导致Cu(HCOO)2·4H2O含量的测定结果偏高的是___________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
学习小组设计了如下图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质: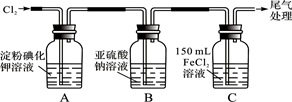
(1)通入氯气后,A中的现象是。C装置中发生反应的离子方程式为:。
(2)通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-。该试验方案,检验B瓶溶液中Cl-和SO42-的存在。
| 实 验 步 骤 |
预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加。 |
若产生白色沉淀,则B瓶溶液中存在SO42-。 |
 步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2 mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置。 步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2 mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置。 |
产生白色沉淀。 |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加0. 1 mol/L AgNO3溶液,振荡。 |
。 |
实验步骤2的目的是:。
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量。实验如下:
①配制250 mL 溶液:将C瓶中全部溶液取出盛于250 mL容量瓶中,并准确配制成250 mL溶液。确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,将0.20 mol/L KMnO4溶液装入滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
(反应方程式: Fe2++MnO4-+H+ — Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=mol。