(13分)某学习小组利用下列装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3实验
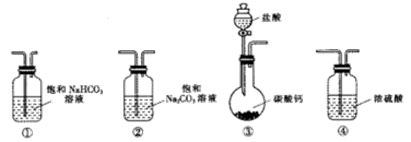
(1)选取必要的实验装置,正确的连接顺序为______(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象。
乙方案:将样品溶液与BaCl2 观察现象。
丙方案:测定PH法
丁方案:热重分析法
①判定甲方案______(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下。
| NaHCO3溶液 BaCl2溶液 |
0.2mol/L |
0.1mol/L |
0.02mol/L |
| 0.2mol/L |
浑浊 |
浑浊 |
少许浑浊 |
| 0.1mol/L |
浑浊 |
少许浑浊 |
无现象 |
| 0.02mol/L |
少许浑浊 |
无现象 |
无现象 |
(i)此实验可说明乙方案是不可行的。请结合以下数据,并通过计算说明产生浑浊的原因。答:______。[已知:0.1 mol·L-1NaHCO3溶液电离出的c(CO32-)为0.0011 mol·L-1,Ksp(BaCO3)=5.1×10-9]
(ⅱ)产生浑浊的离子方程式为_________________。
③使用pH计进行测定的丙方案是______________。
④进行丁方案实验,测得样品在不同升温速率下 的热重曲线如图。

请填空:
(i)样品的纯度为___________。
(ⅱ)升温速率对实验结果_______(填“有较大”、“有较小”或“没有”)影响。
MnO2是一种重要的催化剂。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)写出1个用二氧化锰作催化剂的化学反应方程式。
(2)第②步反应的离子反应方程式为。
(3)检验过滤Ⅰ所得的MnO2是否洗涤干净的方法是。
(4)第③步反应的化学反应方程式为。
(5)上述流程中可用于循环使用的物质是(填化学式);过滤操作和蒸发操作中都要用到的玻璃仪器是。
(6)若粗MnO2样品的质量为25.38g,第①步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则样品中所含的MnO质量为g。
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。
合成反应原理为:
实验步骤如下:
步骤1:在三口烧瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器(反应装置如图)。
步骤2:缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3:等酯化到一定程度时,升温至150℃
步骤4:冷却,倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5:减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)搅拌器的作用。
(2)图中仪器a名称及作用是;步骤3中确定有大量酯生成的依据是。
(3)用饱和食盐水代替水洗涤的好处是。
(4)碳酸钠溶液洗涤的目的是。
(5)用减压蒸馏的目的是。
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1MgSO4溶液和0.5mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL四口烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是。
②步骤3生成MgCO3·nH2O沉淀的离子方程式为。
③步骤4检验是否洗涤干净的方法是。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
①图中气球的作用是。
②上述反应后期要升温到30℃,主要目的是。
③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为(用含a的表达式表示)。
(3)称取100g上述晶须产品进行热重分析,热重曲线如图。
则该条件下合成的晶须中,n=(选填:1、2、3、4、5)。
在金属冶炼和电子工业中,钙常作为空气的除气剂,以除去微量的氮氧气。一化学兴趣小组对金属钙在空气中燃烧的产物做了以下探究实验。取一定量的钙在空气中加热,使其充分燃烧,燃烧时火焰呈砖红色,燃烧后得白色固体M。将M研细后称取4.84g放入锥形瓶B中,滴加适量水使固体完全反应,通过下图测量生成的气体体积,进而推算白色固体的成分。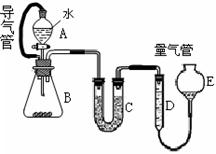
(1)用洁净铂丝蘸取CaCl2溶液在无色灯焰上灼烧,现象为__________。连接A和B的导气管的作用是___________________________,C中所加颗粒状固体是_______________。
(2)量气管D、E中应加的液体是_________。
A.水B.四氯化碳 C.乙醇D.盐酸
(3)实验中,B瓶壁发热。B中反应结束后,读取量气管中气体体积时,正确的操作为______________________。
(4)读取D中气体体积时,B、C中仍有少量产物气体,是否影响应该测得的气体体积__________________。
(5)若在D中得到气体448mL(已换算为标况),该气体有刺激性气味、能够使湿润的红色石蕊试纸变蓝,则4.84g固体M中的成分(填化学式)及其质量为________________。
亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4·FeSO4·6H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓
如图为制取摩尔盐的简要流程:
请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是。
(2)步骤②中的操作是加热蒸发、、。为什么不能加热蒸干?。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的试纸、稀盐酸和溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和,预期的现象和结论是。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4. 0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL
①本实验的指示剂是(填字母)。
| A.酚酞 | B.石蕊 | C.甲基橙 | D.不需要 |
②KMnO4溶液置于_(填“酸式”或“碱式”)滴定管中·
③滴定终点的现象是___。
④产品中Fe2+的百分含量是___。