(选做)【化学——选修2:化学与技术】
下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。

根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸腾炉发生反应的化学方程式: 。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙的化学方程式 。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸 吨。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。
, (写出两点即可)。
下图为实验室制取氨的实验装置。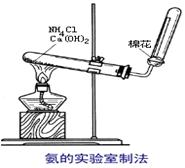
(1)写出A中所发生反应的化学方程式______________________________________________。
(2)该装置还可以制备哪种气体________。
(3)在收集氨时试管口棉花团的作用是。
(4)收集氨气应使用__________法,要得到干燥的氨气可选用__________作干燥剂.
下图中的实验装置可用于制取乙炔。请填空: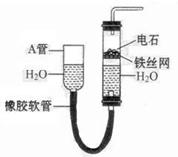
(1)图中,A管的作用是。
制取乙炔的化学方程式是。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是,乙炔发生了反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是,乙炔发生了反应。
(4)为了安全,点燃乙炔前应,乙炔燃烧时的实验现象是。
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。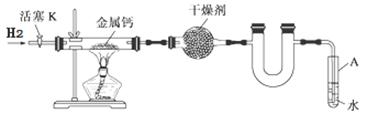
(1)试管A的作用有;。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
②;
③点燃酒精灯,进行反应;
④反应结束后,;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、;
②判断滴定终点的方法是;
③产品中两种成分物质的量之比为。
(共14分)乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: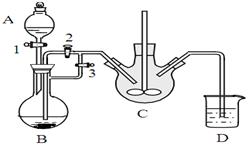
回答下列问题:
(1)NH4HCO3盛放在装置中(填字母),该装置中涉及的主要反应的离子方程式_
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是。反应结束后,无需过滤,除去过量铁粉的方法是_
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:
Ce4++Fe2+=Ce3++Fe3+
则产品中乳酸亚铁的质量分数为_
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是:、。
液体石蜡鼓泡瓶的作用是:。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。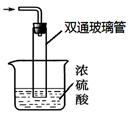
双通玻璃管的作用:;浓硫酸的作用:、。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____。