20.(11分) 如图是某同学设计的放热反应的观察装置,其实验操作是:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液)打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹;
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,即可观察.
试回答:
(1) 实验中观察到的现象是 。
(2) 该实验中必须进行的一步实验操作是 。
(3) 该实验的原理是 。
(4) 实验中发生的化学反应方程式: 。
(5) 说明CaO、H2O的能量与Ca(OH)2能量之间的关系: 。
(6) 若该实验中CaO换成NaCl,实验还能否观察到相同现象? (填“能”或“否”).
(12分)某学生欲配制6.0mol/L的H2SO41000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._____________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意。
(14分)
(一)下列有关实验操作或判断不正确的是(填序号)。
A.配制一定物质的量浓度溶液,定容时平视刻度线。
B.苯、四氯化碳、乙醇三种有机溶剂都可用来萃取溴水中的溴。
C.让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路”。
D.配制100mL1mol/L的NaOH溶液,需称量4g的氢氧化钠固体。
E.用铂丝蘸取少量溶液做焰色反应,没有观察到紫色,所以该溶液中不含钾元素。
(二)实验室需要480mL0.1mol/LNa2CO3溶液,现用碳酸钠晶体配制,回答下列问题:
(1)应用托盘天平称取十水合碳酸钠(Na2CO3·10H2O)晶体g。
(2)本实验还需要的仪器有。
(3)若实验遇下列情况,溶液的浓度将会(填偏高、偏低、不变)
A.加水定容时俯视刻度线;
B.容量瓶内壁附有水珠而未干燥处理;
C.称量的碳酸钠晶体部分失结晶水;
(4)请你帮助把标签上的内容写一下(如图)。
某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。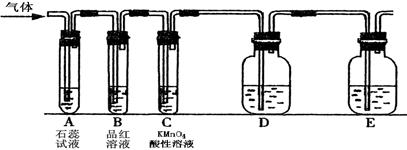
(1)从物质分类的角度,SO2属于(填“酸性”或“碱性”)氧化物。写出硫酸型酸雨形成的反应方程式:,。
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是。
②当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是。
(2)从元素化合价的角度分析,SO2的性质。
①当向该装置通入SO2一段时间后,可观察C中溶液褪色,MnO4-转化为Mn2+,说明SO2具有性,反应的离子方程式为。
②如验证SO2还具有另一方面的性质,可选择的药品是。
| A.过氧化氢 | B.浓硫酸 | C.氯水 | D.硫化钠溶液 |
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 |
操作 |
现象 |
| I |
向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 |
溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 |
操作 |
现象 |
| II |
用激光笔照射步骤I中的红褐色溶液 |
出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 |
操作 |
现象 |
| III |
向1 mol•L-1的FeCl3溶液中通入一定量的SO2 |
溶液由黄色变为红褐色 |
| IV |
用激光笔照射步骤III中的红褐色溶液 |
没有出现“丁达尔效应” |
①经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是______(填字母)。
a.K3[Fe(CN)6] 溶液b.KSCN溶液c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因:。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式为___________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):________→______→_______→_________。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是__________,C瓶溶液的作用是___________。
(4)装置②中所加的固体药品是________,可确证的产物是_________,确定装置②在整套装置中位置的理由是__________。
(5)装置③中所盛溶液是__________,可验证的产物是____________。