(14分)(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)  1/4CaS(s)+CO2(g) ∆H1
1/4CaS(s)+CO2(g) ∆H1
②CaSO4(s)+CO(g)  CaO(s)+CO2(g) +SO2(g) ∆H2
CaO(s)+CO2(g) +SO2(g) ∆H2
③CO(g)  1/2C(s)+1/2CO2(g) ∆H3
1/2C(s)+1/2CO2(g) ∆H3
则反应2CaSO4(s)+7CO(g)  CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的∆H=
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的∆H=
(用∆H1、∆H2和∆H3表示)
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH____(填“>”“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将 (填“增大”“减小”或“不变”)。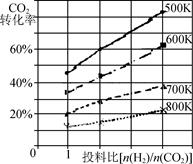
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n) H2O=2nCuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的总的离子方程式: 。
请按要求回答下列问题:
(1)非诺洛芬是治疗类风湿性关节炎的药物,其结构简式为 。它的含氧官能团名称为,能发生的有机反应类型有。
。它的含氧官能团名称为,能发生的有机反应类型有。
(2)4-甲基-2-戊烯的结构简式为。
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
⑥ |
② |
|||||
| 3 |
③ |
④ |
⑤ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)画出①的原子结构示意图:, ⑩的元素名称:
(2)③④⑤原子半径由大到小的顺序是(填元素符号)
(3)表中最活泼的金属是,非金属性最强的元素是;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:。
(5)用电子式表示③与⑥的化合物的形成过程:。
由铜、锌和稀硫酸组成的原电池中:
(1)锌是极,电极反应式是。
(2)铜是极,电极反应式是。
(3)在铜极上可以观察到有(填实验现象)
根据下图所示回答有关问题:
(1)甲池为(选填“原电池”或“电解池”),石墨A上发生的电极反应式为:。
(2)乙池中Zn棒为极, Zn棒上发生反应的电极反应式为:。
(3)石墨B上刚好有9.6克物质析出时,则反应过程中转移的电子数为。
牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸,乳酸的结构简式为 。已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
。已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
(1)写出乳酸分子中官能团的名称。
(2)一定条件下乳酸能发生的反应类型有______________ (填序号)。
| A.水解反应 |
| B.取代反应 |
| C.加成反应 |
| D.中和反应 |
E.氧化反应
F.酯化反应
(3)写出过量乳酸与碳酸钠溶液反应的化学方程式。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此有机生成物的结构简式_____。