对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。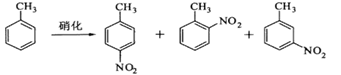
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |
n(催化剂) n(甲苯) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
| 对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
|||
| 浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
| 1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
| NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
| 0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
| 0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
| 0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有 。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。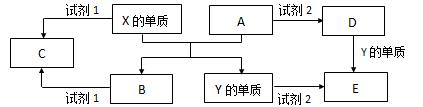
(1)Y元素在元素周期表中的位置周期族
(2)X的单质与A反应的化学方程式是。
(3)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是。
(4)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成, 该反应的化学方程式是。
该反应的化学方程式是。
有A、B、C三种短周期元素在周期表中相对位置如下图:
| A |
|||
| B |
C |
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:>>(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫色(透过钴玻璃),室温下0.1mol/LZ水溶液pH=13。X、Y、Z有如图转化关系:
①写出X与Z反应的离子 方程式:。
方程式:。
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的电子式,丁的水溶液pH7(填“大于”“小于”或“等于”),其原因为
(用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/LKMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式。
④写出X与水反应生成两种酸的电子式,。
用下列装置能达到有关实验目的的是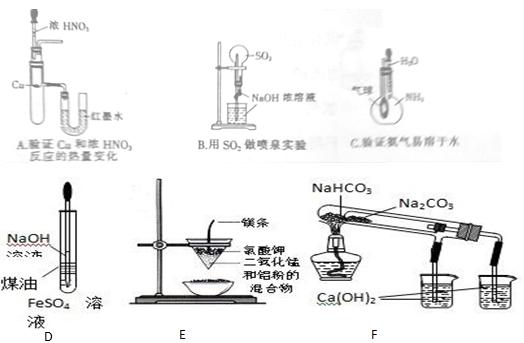
写出A、B、F中发生的化学反应方程式:
A
B
F(试管中的反应)
他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是____________________ __;
要得出正确的实验结论,还需控制的实验条件是___ _____。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定 量实验。完成该实验应选用的实验药品是 ;
量实验。完成该实验应选用的实验药品是 ;
应该测定的实验数据是____________________________。
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g) 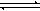 CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率(填“增大”、“减小”或“不变”),容器内混合气体的压强(填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有(选填A、B、C、D)。
| A |
B |
C |
D |
|
n(CO2 ) ) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是。