(15分,每小题3分)某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。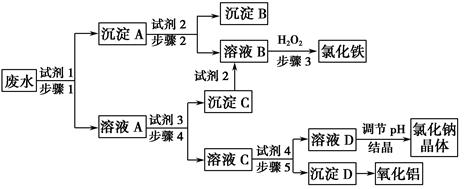
请填写下列空白:
(1)图中试剂1是__ __,试剂2是__ ___。
(2)步骤1和步骤2所用到的玻璃仪器是__ ______。
(3)步骤1反应的离子方程式为__________ __________。
(4)步骤3反应的离子方程式为_________ ___________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____ 。
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1②
H2O(1)=H2O(g) △H=+44kJ·mol-l③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H=,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。
则该电池的正极反应____ ___
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。
⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
| t(S) |
0 |
2 |
4 |
6 |
8 |
10 |
| n(H2O2) (moL) |
0.8 |
0.7 |
0.62 |
0.55 |
0.27 |
0.03 |
在上述表格中已知某一时刻向H2O2溶液中加入催化剂,则加入催化剂后整段时间内H2O2的平均分解速率___________。
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。

①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
(Ⅰ)、A、B、C、D、E、五种元素均是短周期元素,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,反应条件均省略。回答下列有关问题:
⑴X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中,待水不在上升时,试管内溶质的物质的量浓度是(假设溶质不扩散)
⑵若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式
⑶G是一种既能与强酸又能与强碱反应的酸式盐,则G的电子式,取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是,此时测得溶液的PH=12,则此条件下G中阴离子的电离平衡常数Ka =
(Ⅱ)⑷某温度时,向AgNO3溶液中加入K2CrO4溶液会生成
Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是_________。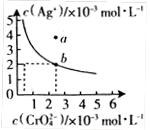
A. Ag2CrO4的溶度积常数(Ksp)为1×10-8
B. 含有大量CrO 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+
C. a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D. 0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2CrO4溶液等体积混合会生成沉淀
⑸若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至_______。
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):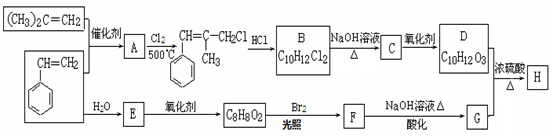
已知:①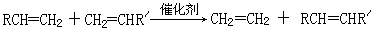
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)A→B反应过程中涉及的反应类型有、。
(2)生成A的化学方程式: 。
(3)D分子中含有的官能团名称:。
(4)E的分子式:。
(5)H的结构简式:。
(6)同时满足下列条件的G的同分异构体有种(不包括立体异构):
①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基。
其中核磁共振氢谱为5组峰的为(写结构简式)。
A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B,G。
(2)写出F的价电子排布图:。
(3)写出化合物BC的结构式:。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)
选修:化学与技术】(金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下: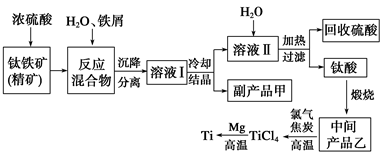
已知反应:①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法:。