(15分)KMnO4是常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产,即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,简略生产过程如下:
(1)反应器中反应的化学方程式为: 。
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量 (填“偏高”或“偏低”),其中Al的氧化物和KOH溶液反应的化学方程式为: 。
(3)电解槽中阳极的电极反应方程式为: ;
(4)在传统工艺中得到K2MnO4后,向其中通入CO2制备KMnO4,化学反应方程式为:3K2MnO4+2CO2=2KMnO4+ MnO2+ 2K2CO3根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工艺相比,电解法的优势是 。
(5)测定高锰酸钾样品纯度的方法是:向高锰酸钾溶液中滴加硫酸锰溶液产生黑色沉淀,反应的离子方程式 。
(6)已知常温下KSP﹝Mn(OH)2﹞=2.0×10-23,工业上调节PH沉淀废水中的Mn2+,当pH=10时,
c(Mn2+)= mol/L。
已知A、B、C、D四种短周期元素在元素周期表中的相对位置如下图所示,它们的原子序数之和为46。请填空: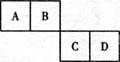
(1)C元素的元素符号为D元素的原子结构示意
图。
(2)A元素可以形成多种同素异形体,其中硬度最大、不导电的是(填物质的名称),其中形似足球的是(填化学式)。
(3)B有多种氧化物,其中之一是一种无色气体。该气体在空气中会迅速变成红棕色,在一定条件下,4 L的该无色气体与3 L的氧气相混合,被足量的水完成吸收,且只生成一种B的含氧酸,该含氧酸的化学式为 。
(4)离子半径:D﹣C2﹣(填“>”、“<”、“=”)。
还原性:D﹣C2﹣(填“>”、“<”、“=”)。
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
回答下列问题:
(1)上述方案中,能测出Mg的质量分数的方案是(填写代号,下同)
A.实验设计1 B.实验设计2 C.实验设计3 D.都可以
(2)上述方案中的化学反应体现了Mg、Al的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)某同学设计了右图装置。该装置适合的实验设计是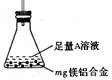

用该装置测定镁铝合金中镁的质量分数,所需的实验操作是
。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.称量反应前后,装置和药品的总质量
(4)若按实验设计3进行实验。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是(填化学式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数;
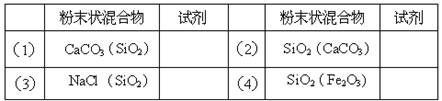
在下表中填入除去各粉末状混合物中的杂质(括号内为杂质)所用的试剂。将所选试剂的代号填入表内“试剂”栏相应的空格内。
可供选择的试剂:
| A.盐酸, | B.氢氧化钠溶液, | C.氧气, | D.水,E.二氧化碳 |
工业上用铝土矿(主要成分为Al2O3,还有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(1)铝合金的用途是;(写出两种即可)
(2)写出加入盐酸后生成Al3+的离子方程式:
(3)写出固体A中加入烧碱后生成SiO32-的离子方程式:
(4)验证滤液B中含Fe3+,取少量滤液B并加入(填试剂名称)
查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为:。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属,②第2步属。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O