(10分)氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应:C(s)+ H2O(g)  CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。
Ⅱ.在同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式在2L容器中投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式在2L容器中投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
1.5 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2b.v(N2)正=3v(H2)逆c.容器内压强保持不变d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=1.5mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)。
在一固定容积的密闭容器中,在一定条件下进行以下化学反应:A(g)+2B(g) 3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
(1)达到化学平衡时,C在反应混合气中物质的量百分含量为_________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到化学平衡后,C的物质的量为________mol(用字母a表示)。此时C在反应混合气体中的物质的量的百分含量_________(填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,并要求达到化学平衡后C在反应混合气体中的百分含量不变,则还应加入C_________mol。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:______________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
在容积可变的密闭容器中,可逆反应2HI(g) H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
(1)正反应速率______________;
(2)逆反应速率______________;
(3)平衡______________;
(4)容器内颜色______________;
(5)H2的质量分数______________;
(6)混合气体的平均相对分子质量______________;
(7)H2的浓度______________;
(8)HI的分解率______________;
(9)混合气体的密度______________;
(10)混合气体的质量______________。(用“变大”“变小”“不变”“加深”“变浅”填写)
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2 2CO+O2
2H2+O2 2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_________和_________,或_________和_________ (填它们的化学式)。
(2)若平衡时O2和CO2的物质的量分别为n平(O2)="a" mol,n平(CO2)="b" mol。试求n平(H2O)="________" (用含a、b的代数式表示)。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: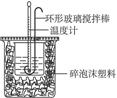
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:______________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。