下表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是
| |
X |
|
| Y |
Z |
R |
| W |
|
|
A.五种元素的原子最外层电子数一定都大于2
B.X、Z原子序数可能相差18
C.Z可能是氯元素
D.Z的氧化物与X单质不可能发生置换反应
根据下列框图,有关说法正确的是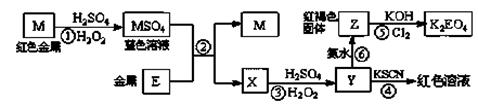
| A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O ==3EO4 2―+ 6Cl― +12H+ |
| C.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42―+4H2O+3e-="=" E(OH)3+5OH― |
| D.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、M2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见下图。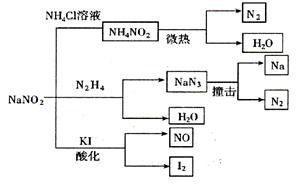
下列说法不正确的是
| A.NaNO2的稳定性大于NH4NO2 |
| B.NaNO2与N2H4反应,NaNO2是氧化剂 |
| C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| D.NaN3分解,每产生1 molN2转移6 mol e- |
下列有关实验原理或实验操作正确的是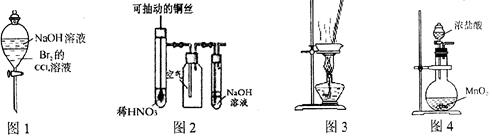
| A.图1装置可以用于除去溶解在CCl4中的Br2 |
| B.图2所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| C.用图3装置在蒸发皿中灼烧CuSO4•5H2O晶体以除去结晶水 |
| D.实验室常用图4装置制取少量氯气 |