将还原性铁粉分别放入冷的浓H 2 SO 4 、浓HNO 3 中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H 2 SO 4 中生成的气体呈无色,HNO 3 中生成的气体呈红棕色;剩余的固体经检验有磁性。试回答:
(1)Fe的氧化产物是________。(写化学式,下同)
(2)浓H2SO4的还原产物是________,浓HNO3的还原产物是________。
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V型分子,c的+1价离子比e的﹣1价离子少8个电子.
回答下列问题:
(1)元素a为,c为;
(2)由这些元素形成的双原子分子为;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线型的是,非直线型的是(写两种);
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是;(每空填一种)
(5)元素a和b形成的一种化合物与c和d形成的一种化合物发生的反应常用于防毒面具,该反应的化学方程式为.
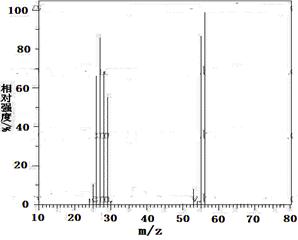
现有2.8g有机物A,完全燃烧生成0.15molCO2和1.8gH2O,A的质谱图如右图所示:已知: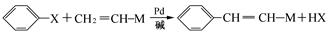 (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: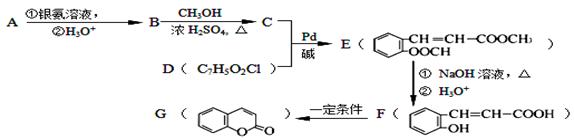
回答下列问题:
(1)A的分子式为。
(2)写出C中含氧官能团名称: ;F→G 的反应类型是。
(3)写出A和银氨溶液反应的化学方程式 。
(4)D的结构简式为 。
(5)二氢香豆素( 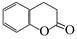 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(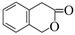 )需要用到的试剂有:NaOH溶液、 。
)需要用到的试剂有:NaOH溶液、 。
(6)F有多种同分异构体,写出同时满足下列条件的两种同分异构体的结构简式: 。
Ⅰ. 分子中除苯环外,无其它环状结构; Ⅱ.苯环上有两个处于对位的取代基;
Ⅲ. 能发生水解反应,不能与Na反应;Ⅳ.能与新制Cu(OH)2按物质的量比1:2发生氧化反应
(7)又知: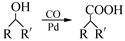 (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯(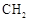 =CH—CH3)为原料,合成
=CH—CH3)为原料,合成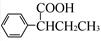 的路线流程图如下:
的路线流程图如下: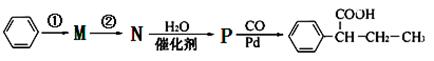
步骤①的反应条件和试剂____________,步骤②的反应类型____________,P的结构简式。
X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是,沸点最低的是。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因。
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
| T/K |
303 |
313 |
323 |
353 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+O2(g)△H=+765.2 kJ/mol (I)
请回答下列问题:
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。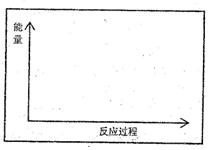
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议:。
(3)写出工业上用H2和N2直接合成NH3的化学方程式,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为;反应的平衡常数K=(不要求写单位)。
(18分)化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:
已知以下信息:① A的核磁共振氢谱表明其只有一种化学环境的氢;
②R—CH=CH2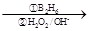 R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的结构简式为 ,B所含官能团的名称是。
(2)C的名称为,E的分子式为。
(3)A→B、C→D、F→G的反应类型分别为、、。
(4)写出下列反应的化学方程式;
D→E第①步反应;
F→G。
(5)I的结构筒式为。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式。