工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。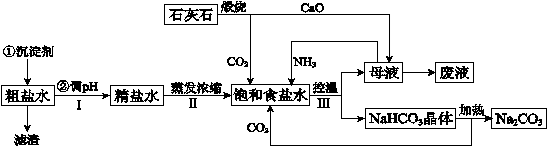
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下: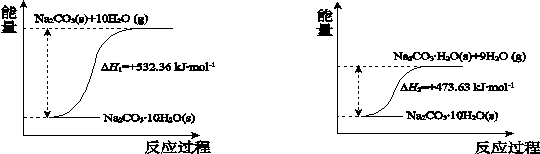
Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是 。
由乙烯和其他无机原料合成环状化合物E,其合成过程如下:(水及其他无机产物均已省略)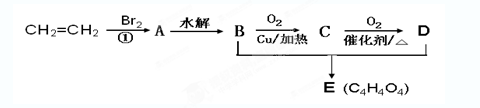
试通过分析回答下列问题:
(1)写出C的结构简式__________________
(2)物质X与A互为同分异构体,则X的结构简式为_________________________
(3)指出上图变化过程中①的有机反应类型_______________________
(4)D物质中官能团的名称____________________________
(5)写出B和D生成E的化学反应方程式_________________________(注明反应条件)
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。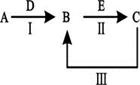
(1)若A为短周期常见金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。用离子方程式表示B溶液pH>7的原因;
(2)若A是淡黄色化合物;常温下D是无色气体;C为常见强碱,含有的阴、阳离子均为10电子粒子。
① C中所含化学键的类型是;
②写出反应I的化学方程式;
③将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为,a点溶液中各离子浓度由大到小的顺序是。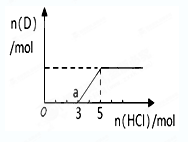
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+)__________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx 浓度的有(填字母)
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式,已知该反应合成1 mol液态甲醇吸收热量131.9 kJ, 2H2 (g) + CO(g) + 3/2O2g) =CO2 (g) +2H20 (g)△H =-594.1 kJ·mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式。
(3)有人设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。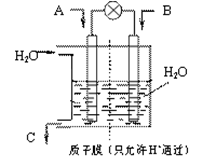
若A为CO2,B为H2,C为CH3OH,则通入CO2的一极为极;若A为SO2,B为O2,C为H2SO4。则负极的电极反应式为;
(4)①在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×105 Pa时,
2NO2(g) 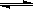 N2O4(g)△H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
N2O4(g)△H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
c (N2O4)=(保留两位有效数字);
②改变上述体系的某个条件,达到新的平衡后,测得混合气体中 c (NO2) =" 0.04" mol·L-1, c (N2O4) =" 0.007" mol·L-1,则改变的条件为;
( 16 分)丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下: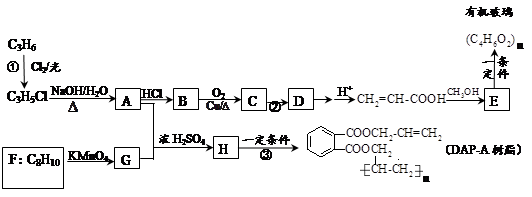
|
试回答下列问题:
(1)写出下列物质可能的结构简式: