制备相同质量的硝酸铜,从经济效益和环保角度考虑,最适宜采用的方法是
| A.Cu+HNO3(浓)→Cu(NO3)2 |
| B.Cu+HNO3(稀)→Cu(NO3)2 |
| C.Cu+AgNO3→Cu(NO3)2 |
D.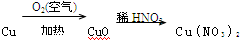 |
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是 
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
C.25°C时,Mg(OH)2固体在20ml0.01 mol·L-1氨水中的Ksp比在20mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
下图是一甲醇(CH3OH)燃料电池的化学原理示意图,下列判断不正确的是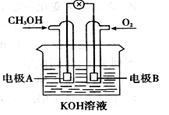
| A.电极A为电池负极 |
| B.电极B表面上发生还原反应 |
| C.工作一段时间溶液pH保持不变 |
| D.燃料电池工作时不会出现火焰 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 | B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 | D.水的离子积变大、pH变小、呈中性 |
用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作情况会使测得的氢氧化钠溶液浓度偏低的是
| A.酸式滴定管用水润洗后,直接注入标准浓度的盐酸 |
| B.滴定过程中,滴定管有少量漏液 |
| C.滴定前读数准确,滴定完毕俯视读数 |
| D.锥形瓶用水润洗后,再用待测的氢氧化钠润洗 |