某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象。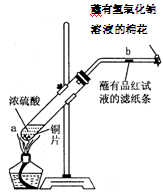
回答下列问题:
(1)写出试管中发生反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)蘸有NaOH溶液的棉花团作用是 。
(4)硫酸型酸雨的形成过程可用下列反应中的 来表示。
A:SO2+H2O H2SO3
H2SO3
B:O2+2H2SO3=2H2SO4
C:SO2+H2O2=H2SO4
已知A、B是常见的气体单质且B呈黄绿色,F遇KSCN溶液变血红色,各物质之间的转化关系如右图所示。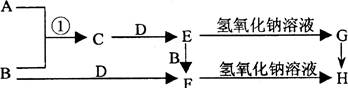
(1)写出下列各物质的化学式:D、E、G 。
(2)写出反应①的化学方程式:。
写出F→H的离子方程式 。
(3)描述G→H反应的现象。
将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:。
B组:。
下列物质中(1)Na(2) Br2(3)Na2O(4)NO2 (5)CO2(6) SO3(7)NH3 (8)H2S(9)HCl (10)H2SO4(11)Ba(OH)2(12) NaCl (13)蔗糖 (14)NaCl溶液。
属于电解质的是, 属于非电解质的是 ,
能导电的是。(用序号填写)
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填空:
| A.Na2O2 +2HCl= 2NaCl+H2O2 | B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 | D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)。
(3)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:。
为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
合成塔中反应的化学方程式为;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了。
虑温度对反应速率的影响外,还主要考虑了。
从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母)。
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括。
(4)在体积为2L的合成塔中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2) =______________;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有。
(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知CH4(g)+2O2(g)=" CO2(g)+2H2O(l)" ΔH1=-890.3kJ/mol
H2 (g)+ O2(g)=" H2O(l)" ΔH2=-285.8kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________。