a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为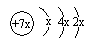 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为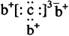 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a>c>d>b | B.电负性a>b>d>c |
| C.原子序数:a>d>b>c | D.最高价含氧酸的酸性c>d>a |
基态碳原子的最外能层的各能级中,电子排布的方式正确的是
A B C D
D
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是:
| A.X2YZ3 | B.X2YZ4 | C.XYZ2 | D.XYZ3 |
下列各组分子中,都属于含极性键的非极性分子的是
A.CO2H2S |
B.C2H4CH4 |
| C.C60 C2H4 | D.NH3 HCl |
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的轨道和另一个原子的p轨道以“头碰头”方式重叠而成 。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H 2 2 |
B.HCl | C.Cl2 | D.F2 |