哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式: ;
检验氨气已收集满的方法是:用湿润的 色石蕊试纸靠近集气瓶口,现象为试纸变为_____色;
(2)用图装置进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是 、 ;
(3)自然界中固氮过程很多。打雷时发生的固氮反应方程式为 ;
(4)氨气是制取硝酸的基本原料。
①请写出氨催化氧化生成为NO的方程式 ;
②产物NO能发生下列反应:aNO+bO2+cH2O="==" dHNO3
从电子得失相等角度分析可知a:b= 。
将饱和FeCI3溶液滴入沸水中可以得到的氢氧化铁胶体,请回答下列问题:
(1)该氢氧化铁胶体粒子直径在 之间。
(2)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色 ,这个现象说明 ,胶体的这种性质称为电泳。
(3)向氢氧化铁胶体中滴入过量稀硫酸,现象是
(4)除了以上性质外,氢氧化铁胶体还具有的性质有 。
(5)写出制备氢氧化铁胶体的化学方程式 。
(l)一块金属钠露置于空气中,可以观察到如下现象:
银白色→变灰暗→变白色→出现液滴→白色固体
请写出变化过程中可能发生的反应的化学方程式:
(2)一块金属钠直接空气中加热充分反应。①可以观察到的现象为发生反应的化学方程式为 ;②若将反应后的产物投入到水槽中,则发生反应的化学方程式为 ,此反应中的氧化剂是 ,被氧化的元素是
A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,C与A同主族,C元素的原子序数是B的2倍,工业上以D元素的单质与石灰乳为原料制造漂白粉。按要求回答下列问题:
(1)B的原子结构示意图为 ;镁条在气体B中燃烧生成的物质是 (填化学式);
(2)A的非金属性强于C,请用一个化学反应方程式表示_______________;
(3)写出元素D的单质与石灰乳制漂白粉的化学方程式 。
向20 mL某物质的量浓度的AlCl3溶液中滴入2 mol·L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题: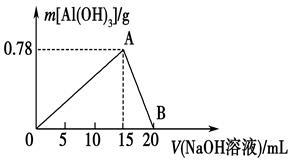
(1)图中A点表示的意义是_________________________。
(2)图中B点表示的意义是_________________________。
(3)上述两步反应用总的离子方程式可表示为:__ ____。
(4)若所得Al(OH)3沉淀0.39 g,则此时用去NaOH溶液的体积为______________。
(1)铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为: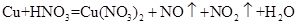 (未配平)
(未配平)
①硝酸在该反应中的作用是__________________,
②19.2g Cu被硝酸完全溶解后,若得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是__________________。
(2)①已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + = HCl + H3PO4
配平上述反应方程式。
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O = 20Cu3P + 24 H3PO4 + 60 H2SO4
在该反应中30molCuSO4可氧化P4的物质的量是 。