(10分)已知草酸晶体( )可溶于水,并可与酸性高锰酸钾溶液完全反应:
)可溶于水,并可与酸性高锰酸钾溶液完全反应:
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
| |
第一次滴定 |
第二次滴定 |
第三次滴定 |
| 待测溶液体积(mL) |
25.00 |
25.00 |
25.00 |
| 标准溶液体积(mL) |
9.99 |
10.01 |
10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在 (填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是 (填序号)。
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是 。
(4)根据上述数据计算X= 。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 ;
②若KMnO4标准溶液浓度偏低,则X值 。
常温下,某工厂以浓硫酸、浓硝酸、粗铜、水和空气为原料,设计如图所示制取硫酸铜晶体(CuSO4·5H2O)的生产工序和流程。
回答下列问题:
(1)(I)中制取硫酸铜的总反应的化学方程式为。
(2)在上述反应中可以被循环利用的物质为(写化学式)。
(3)①某同学在实验室中模拟上述生产过程实现上述方案,请根据该同学的思路在下列装置中选用适当的装置,并将它们的编号填入方框内。
②装置C的作用是。
(4)硫酸铜晶体也可以直接用浓硫酸和粗铜反应制取,与上述方法相比,其缺点是。
碘酸钾是一种白色结晶粉末,无臭无味。在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下图所示。
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:。
(2)步骤②中,用硝酸而不用HI,其原因可能是。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为。
(4)参照下表碘酸钾的溶解度,步骤⑾得到碘酸钾晶体,应采用的方法是。
| 温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3(g/100g水) |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阴极的电极反应式为。
右图表示在没有通风橱的条件下制备氯气时设计的装置, 图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。)
⑴仪器A的名称是;水槽中应盛放的 是;烧杯中盛放的是 ;
;
烧瓶中反应的化学方程式;
⑵当收集氯气时打开,关闭___。当氯气收集完毕时打开,
关闭___。(填a,b)烧杯中反应的化学方程式。
欲用无水CuSO4粉末配 制500mL 0.1mol·L—1CuSO4溶液。根据题意填空:
制500mL 0.1mol·L—1CuSO4溶液。根据题意填空:
(1)如图所示仪器,配制上述溶液肯定不需用到的是(填字母)配制上述溶液还需要的玻璃仪器有 (填仪器名称)。
(填仪器名称)。
(2)配制该溶液应选用mL容量瓶,使用容量瓶之前必须进行。
(3)配制该溶液 应用托盘天
应用托盘天 平称
平称 取g无水CuSO4。
取g无水CuSO4。
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度
偏低的是(填编号)。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(15分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。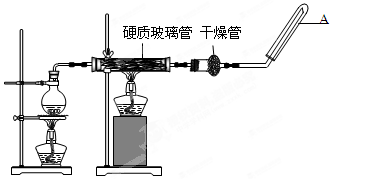
(1)写出该反应的反应方程式 ;
; 并指明该氧化还原反应的还原剂是,氧化剂是。
并指明该氧化还原反应的还原剂是,氧化剂是。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。