某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【猜想】(1)甲同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液,而不能用澄清石灰水鉴别。
(2)乙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别。
依据是 。
(3)丙同学认为可用盐酸鉴别Na2CO3和NaHCO3固体。
【实验探究】
(1)甲同学:①将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现盛有Na2CO3的试管产生了白色沉淀;②将澄清石灰水加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀。
此实验结果与猜想相同。
(2)乙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,乙同学观察到实验现象与①不同,证实了自己的猜想是合理的。
(3)丙同学在两支分别盛有少量Na2CO3、NaHCO3固体的试管中,各加入2 mL
2 mol/L的盐酸,观察到两支试管中均产生了大量气体,实验结果与猜想不一致,即得出不能用盐酸鉴别Na2CO3和NaHCO3。
【问题讨论】
(1)甲同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,该反应的离子方程式为 ;
(2)乙同学在加热Na2CO3固体时,开始产生少量气泡的原因是 ;在加热NaHCO3固体时,乙同学观察到的实验现象是 。
(3)丁同学认为丙同学的结论不对。丁同学认为对实验方案做一些改进,可用于鉴别碳酸钠与碳酸氢钠。他的改进方法是:称取各2.1 g两种固体,放入两个容积一样的气球中,在两只锥形瓶中各加入约25 mL 2 mol/L 的盐酸,分别将气球套在锥形瓶瓶口上,同时将气球中的固体同时倒入锥形瓶中,气球的膨胀比较 (填快或慢)的或最后气球比较 (填大或小)的是碳酸氢钠。
【拓展应用】
(1)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的 溶液。
(2)要测定Na2CO3与NaHCO3固体混合物中Na2CO3的质量分数,可采用的方案有多种,请简述其中一种方案(写出简要步骤及要测定的数据,不要求写出如何用数据求出结果):
。
(12分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的: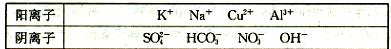
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.若将D的溶液酸化,并加入铜片,则能生成一种气体,该气体遇空气变为红棕色
根据上述实验填空:
⑴ 写出B、D的化学式:B D
⑵ 将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为
⑶ 在A溶液中加入少量澄清石灰水,其离子方程式为
⑷ C常用作净水剂,用离子方程式和适当文字说明其净水原理 
(5)若向含溶质1mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为
克
(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为;
乙同 学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质, 应选用的试剂是。
应选用的试剂是。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是:;
②实验③中溶液变成血红色的离子方程式为。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-(填“大”或“小”)外,还有
(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。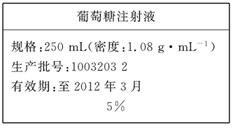
实验用品:葡萄糖晶体(摩尔质量:180 g/mol)、蒸馏水、烧杯、容量瓶(500 mL)、药匙、胶头滴管、量筒。
(1)还缺少的仪器有_。
(2)下列对容量瓶及其使用方法的描述中正确的是__。
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液 时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标有容积、温度和浓度
(3)实验中需取用晶体的质量为____,物质的量浓度__。
(4)配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是__。
A.没有将洗涤液转移到容量瓶 B.定容时俯视读取刻度
C.原容量瓶洗净 后未干燥 D.定容时液面超过了刻度线
后未干燥 D.定容时液面超过了刻度线
18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 ml,实验操作如下:
(1)计算并用量筒量取ml的18.0 mol·L-1的浓硫酸;
(2)将沿烧杯内壁慢慢注入盛有少量的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
(1)没有洗涤烧杯和玻璃棒
(2)定容时俯视读数
(3)容量瓶使用前有少许水残留
右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略 ),其原理与教材中的实验完全相同。
),其原理与教材中的实验完全相同。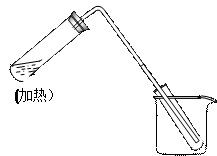
回答下列问题:
(1)左边大试管中要加入几片碎瓷片,其作用是
(2)该装置中使用的玻璃管较长,其作用是
(3)烧杯中还应该加入的物质是