氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 |
O2 |
Ar |
CO2 |
| -196℃ |
-183℃ |
-186℃ |
-78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g.
(4)已知:4NH3+6NO 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________.
现有200mL H2SO4和Na2SO4的混合溶液,其中硫酸的物质的量浓度为1 mol/L,硫酸钠的物质的量浓度为0.5mol/L。若要配制硫酸和硫酸钠的物质的量浓度分别为2mol/L和0.2mol/L的混合溶液,应加入55.8%的硫酸溶液(密度为1.35g/cm3)多少毫升?最后所得混合溶液的体积是多少毫升?
实验室用Na2CO3·10H2O晶体配制240mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)用托盘天平称取Na2CO3·10H2O的质量为g。
(2)操作中所需仪器除托盘天平、烧杯、玻璃棒外,还需要(填仪器名称)。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次);
| A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡 |
| B.用托盘天平称量所需的Na2CO3·10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解 |
| C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,振荡摇匀 |
E.改用胶头滴管加水,使溶液凹液面的最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)溶液注入容量瓶前需恢复到室温,这是因为;
(5)若出现如下情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①没有进行A操作;
② 称量时,Na2CO3·10H2O已失去部分结晶水;
③ 若定容时俯视刻度线;
④ 定容摇匀时,发现液面下降,又加水至刻度线;
⑤ 容量瓶用蒸馏水洗净后没有干燥。
右图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题: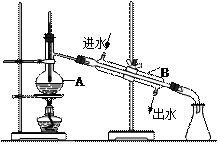
⑴ 图中两处明显的错误是:
,
。
⑵ A仪器的名称是 ,B仪器的名称是。
,B仪器的名称是。
⑶ 实验时A中除加入适量自来水外,还需加入少量,其作用是。
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,一位同学设计了一种制备精盐的实验方案,步骤如下(用于生成沉淀的试剂均稍过量):

(1) 判断BaCl2已过量的方法是______________________________。
(2) 第④步中,相关的离子方程式是_________________________________。
(3)蒸发、结晶时,当中剩余时停止加热。
根据反应8NH3 + 3Cl2 ="=" 6NH4Cl+ N2 ,回答下列问题:
(1) 还原剂是(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为升。