(15分)【 化学——选修3 物质结构与性质】
有A、B、c、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式
(2)A的单质分子中 键的个数为
键的个数为
(3)A、B、c三元素第一电离能由大到小的顺序为 (用元素符号表示)。
(4)B元素的氢化物的沸点是同族元素中最高的,原因是 。
(5)A的最简单氢化物分子的空间构型为 ,其中A原子的杂化类型是 。
(6)c和D形成的化合物的晶胞结构如图,已知晶体的密度为 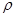 g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含队
g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含队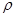 、NA的计算式表示)
、NA的计算式表示)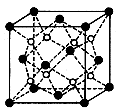
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于过量氢氧化钠溶液后,溶液中铝元素的存在形式为(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:。
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
①;②;③;④。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。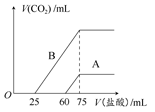
①分别加入足量的盐酸后,溶液中的溶质是,原NaOH溶液的物质的量浓度是。
②A曲线表明,通入CO2后,溶液中的溶质是,与盐酸反应产生CO2的最大体积是mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为,其物质的量之比为。
镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下: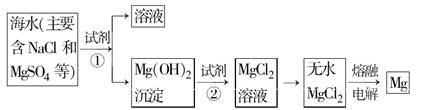
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是。
(3)试剂②可以选用,其反应的离子方程式为。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为L。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为。
(2)在ClO2稳定装置中,H2O2作(选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是(按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
| 步骤Ⅰ |
称取样品Wg于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ |
向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
| 步骤Ⅲ |
用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是,步骤Ⅲ中达到滴定终点时的现象是。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为(用字母表示)。
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出。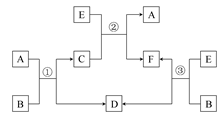
(1)若反应①②③均为水溶液中的置换反应,A、D、E均为卤素单质,则A、D、E的氧化性由强到弱的顺序为,其中A的化学式是。
(2)若B为一种能使湿润的红色石蕊试纸变蓝的气体的水溶液,C是一种溶于强碱不溶于B的白色絮状沉淀,则反应①的离子方程式为。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是。
(4)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。化合物B的化学式为,F的饱和溶液与足量E反应的离子方程式是。