硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化:  。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:
(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C |
其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D |
其氢氧化物和氧化物都有两性,且与C同周期 |
| E |
与C同周期,其原子半径在该周期最小 |
| R |
有多种化合价,其最高正价为+6价 |
回答下列问题:
(1)写出下列元素的名称:C,E;画出B的阴离子结构示意图:。
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)。E元素的最高价含氧酸的化学式是;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是:。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是(填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。;。
请用相关知识回答下列问题:
(1)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程测得的CO2气体体积随时间变化如右图所示。
①________段化学反应速率最快,_______段收集的二氧化碳气体最多。
②除加入蒸馏水外,当加入下列物质中的(填序号)时,则能够减缓上述反应的速率。
A.醋酸钠溶液 B.碳酸钙粉末 C.稀硫酸 D.浓盐酸
(2)原电池是一种能量装置。
①下列在理论上可用来设计原电池的反应是(填序号)。
A.NaOH +HCl==NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4D.C2H6O +3O2==3H2O+2CO2
②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,可以发现产生氢气速率明显加快,其原因是。
Ⅰ.分类法是化学学习的一种十分有效的方法,它可以使我们从不同角度对同一知识做更加深入的了解,人们根据不同的标准,即使同一物质也可能被划在不同的类别中。现有如下物质①MgCl2②HCl ③SO2④ NO2⑤K2CO3⑥ Cl2⑦CaO⑧ NaOH
请根据下列标准,对上述物质进行分类:
(1)既含离子键又含共价键的物质是(填代号,下同)。
(2)只含共价键且为非电解质的是。
(3)含有共价键的化合物是。
Ⅱ.向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况。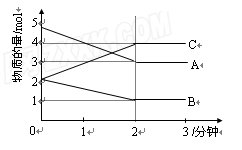
(1)写出该密闭容器发生反应的化学方程式为 。
(2)2分钟后A、B、C各物质的量不再随时间的
变化而变化,其原因是____。
(3)下列情况能说明该反应达到化学反应限度的是。
A.该容器的压强不再发生变化;
B.单位时间内生成A的物质的量与生成C的物质的量相同;
C.该容器中气体的密度不再改变;
D.容器中A的物质的量与C的物质的量相同
把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气态④G是除氢外原子半径最小的元素
(1)A 的名称是,B位于周期表中第周期第族,C的原子结构示意图是
(2)A元素与D元素形成化合物的电子式是
(3)F的元素符号是
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是,酸性最强的化学式是,气态氢化物最稳定的化学式是
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是