针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
①能否各取少许固体用舌头品尝?____________。
②用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有_________性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下
已知:2NO2+2NaOH=NaNO2+NaNO3+H2 O
①写出装置I中发生反应的化学方程式____________________________。
②水_____________(选填“能"或“不能”)作为装置II中的试剂,理由是_____________。
③装置III中反应完全后,接下来的操作是____________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_____(选填“增多”、“减少"或“不变”),原因可能是____________________________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从1000g刚煮熟的肉和1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗16.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2 O)
①滴定终点的判断依据为________________________________________________。
②隔夜熟肉中NaNO2的含量是____________mg/kg。
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产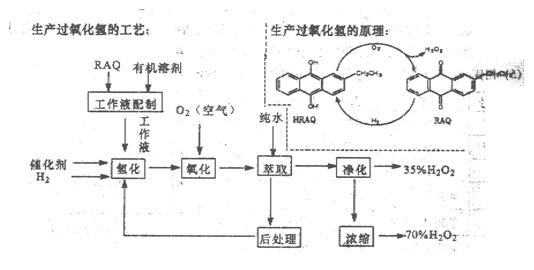
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为。
天然气中伴随有H2S等合硫化合物,脱硫方法有多种:
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为。
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g)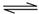 H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s) 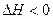 ,高脱硫率可采取的措施是。
,高脱硫率可采取的措施是。
a.高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g) 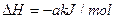
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s) +6S(s)
+6S(s)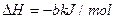
则2H2S(g)+O2(g)=2H2O(g)+2S(s)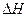 =(用a、b表示)
=(用a、b表示)
(4)一种改进的克劳斯法脱硫的工艺,化学反应如下 :
:
H3S+1.5O2=H2O+SO2 SO2+0.5O2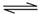 SO3
SO3
SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g)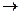 H2SO4(a
H2SO4(a q)
q)
该法最终得到的硫酸溶液的质量分数为。
某工厂对制革工业污泥中 Cr(Ⅲ)回收与再利用工艺如下(硝酸浸取液中金属离子主要是 Cr3+,其次是Fe3+、Ca2+、Mg2+)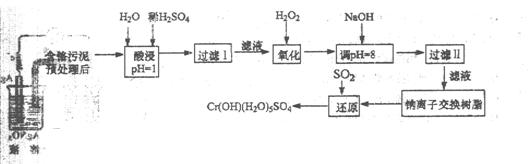
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| pH |
3.7 |
11.1 |
8 |
9(>9溶液) |
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施(至少写一条)。
(2)调pH=8是为了除去离子(选填:Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为:Ma++nNaR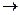 MRa+nNa+,被交换的杂质离子是(选填:Fe3+、Al3+、Ca2+、Mg2+)。
MRa+nNa+,被交换的杂质离子是(选填:Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平还原反应方程式:Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+
Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为 。
。
(共8分)在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g) + H2O(g)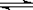 CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
已知CO的浓度变化如图所示。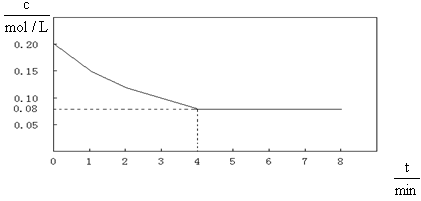
(1)从0~4 min,该反应的平均速率v(CO)=mol/(L·min)。该反
应的平衡常数为。
(2)为了增大CO的转化率,可以采取的措施有。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水
蒸气的起始浓度至少为。
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度= × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式 。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为。