节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g),△H<0
CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)= ;平衡时,容器中CO的转化率为 。
②下图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是 。(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g) CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请在表中的空格处填写“>"“<”或“="。
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为 mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L。
大家知道:Cu+H2SO4(稀)= Cu SO4+H2通常不能反应。请回答:
(1)试说明此反应在一般情况下不能发生反应的原因是_________________。
(2)根据你所学过的知识,设法使其中的反应能发生,具体的方法是_________________;反应原理是:阳极__________________________
阴极__________________________
(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:________________________,已知 H2O(l) = H2O(g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是 kJ 。
(2)已知反应:H2(g)+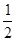 O2(g)==H2O(g)△H1
O2(g)==H2O(g)△H1
N2(g)+2O2==2NO2(g)△H2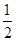 N2(g)+
N2(g)+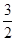 H2(g)==NH3(g)△H3
H2(g)==NH3(g)△H3
利用上述三个反应,计算4NH3(g)+7O2(g)==4NO2(g)+6H2O(g)的反应焓变为__________________(用含△H1、△H2、△H3的式子表示)。
在400℃时,将一定量SO2和14molO2投入一个盛有催化剂的10L密闭容器中进行反应2SO2+O2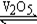 2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
(1)生成了_______ mol SO3, SO2起始物质的量的浓度是________ mol/L―1。
(2)V(SO2)是_______ mol/L―1.min―1, V(SO3)是_________ mol/L―1.S―1。
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: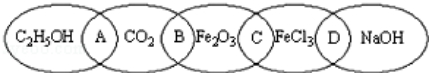
(1)两种物质都是氧化物的是 (填分类标准代号,下同).
(2)分类标准代号A表示
a.两物质都可作燃料 b.两物质都是有机物
c.两物质都是含碳化合物 d.两物质都是氧化物
(3)分类标准代号C物质中的某一物质能与某种强酸反应生成同组物质中的另一种物质,该反应的化学方程式为
(4)图中相连的两种物质可归为一类,又能相互反应的是 (填分类标准代号),其反应的基本类型是 反应.
(5)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为 ,该分散系能发生 现象。
目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠: 2NaCl (熔融)=2Na + Cl2↑。现有如下转化关系: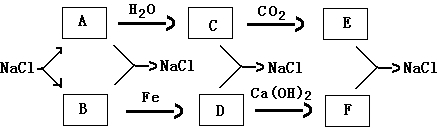
(1)写出下列化学方程式:
A+H2O→C:
C+D→NaCl:
E+F→NaCl:
(2)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用C物质溶液吸收,其化学方程式
为 。
(3)将A投入CuSO4的溶液中,观察到溶液中除了有气泡产生,甲同学认为还有红色铜生成,乙同学认为还有蓝色的Cu(OH)2生成。你支持 同学的观点,理由是