(15分)实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示(加热及夹持装置省略):
制备1,2--溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
回答下列问题:
(1)装置A、D中发生主要反应的化学方程式为: ; 。
(2)装置B中长玻璃管E的作用: 。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(4)在装置C中应加入____,其目的是完全吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸
c.氢氧化钠溶液 d.酸性KMnO4溶液
(5)反应过程中应用冷水冷却装置D.其主要目的是: ;但又不能过度:冷却(如用冰水),其原因是: ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
3位同学设计了下列3个实验方案以验证某无色气体中既含有SO2,又含有CO2。
方案1:将无色气体通入酸性KMnO4溶液,KMnO4溶液褪色,反应后气体通入石灰水,石灰水变浑浊。即可证原无色气体中含有SO2,又含有CO2。
方案2:将无色气体通入溴水,溴水褪色又应后气体通入石灰水,石灰水变浑浊,证明原无色气体中既含有 SO2,又含有CO2。
方案3:将无色气体通入品红试液后再依次通入酸化KMnO4溶液、品红溶液,最后通入澄清的石灰水。结果品红试液褪色、KMnO4溶液颜色变浅品红试液不褪色,石灰水变浑浊,证明原无色气体既含有SO2,又含有CO2。
试回答上述3个方案中,能证明原无色气体中既有SO2,又有CO2的方案是:简述其理由是。
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++ SO32-+H2O=2Fe3+ + SO42-+2H+;二是发生双水解反应2Fe3++3SO32-+6H20=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ、学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干,从选择的药品分析,作者设计这个实验的目的是 。
实验Ⅱ、取5mL FeCl3浓溶液于试管中,逐滴加入NaSO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为 。另一份中加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ、换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。
由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液于氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
A~D是中学化学实验中使用温度计的装置示意图,其中所做实验与装置不相符的是:
| 序号 |
A |
B |
C |
D |
||
| 装置 |
 |
 |
 |
|
||
| 实验 |
乙烯的制取 |
石油的分馏 |
银镜反应 |
苯的硝化 |
下图为配制0.2mol·L-1Na2CO3溶液250mL示意图。
回答下列问题:
(1)①中称得Na2CO3_____________g。
(2)玻璃棒在②、③两步中的作用分别是_____________、_____________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视_____________;
B.没有进行操作步骤④和⑤_____________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
为了测定某烷烃样品(丁烷,并含少量丙烷等气态烃)的平均式量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1
②往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量,重复操作,直到前后两次称量结果基本相同,得到质量m2
③往锥形瓶内加满水,塞好胶塞,称量得到质量m3
已知实验时的温度t(K),压强p(kPa),水的密度ρ水(g·L-1),空气的平均式量29.0、密度ρ空气(g·L-1)
回答下列问题:
(1)本实验的原理是(具体说明)什么?
(2)步骤②中为什么要重复操作,直到前后两次称量结果基本相同?
(3)具体说明本实验中怎样做到每次测量都是在相同体积下进行的?
(4)本实验中收集气体样品的操作,可选用的方法是(填图中标号)。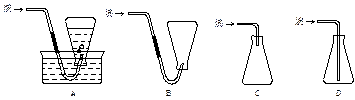
图3—2
(5)锥形瓶内空气的质量(m空气)是(列出算式)。
(6)瓶中样品的质量(m样品)是(列出算式)。
(7)由实验测得烷烃的平均式量是(列出算式)。