物质结构选修模块题
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解。这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是 ;其中水分子里的氧原子轨道的杂化类型是 。将过量氨气通入0.1 mol·L―1的蓝色硫酸铜溶液中逐渐形成深蓝色溶液,其离子方程式为: 。
(2)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。下图是金属钛的面心立方结构晶胞示意图,则钛晶体的1个晶胞中钛原子数为 ,钛原子的配位数为 。
(3)晶体硅、锗是良好的半导体材料。磷化铝、砷化镓也是重要的半导体材料,从物质结构的角度分析它们与晶体硅的关系为 。试以原子实的形式写出31号半导体元素镓的电子排布式 。镓与砷相比较,第一电离能更大的是 (用元素符号表示)。
2005年诺贝尔化学奖授予法国和美国的伊夫•肖万、罗伯特•格拉布和理查德•施罗克,以表彰他们在烯烃复分解反应研究领域作出的卓越贡献。烯烃复分解反应如下所示(炔烃也能发生此类反应):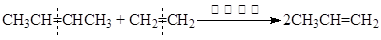 即从总效果看,是双键断裂后部分重新组合。
即从总效果看,是双键断裂后部分重新组合。
(1)以下反应不属于烯烃复分解反应的是______________(填序号)。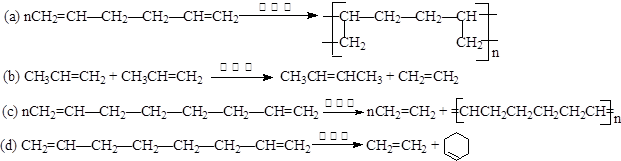 (2)写出丙炔与丙炔发生复分解反应的化学方程式:
(2)写出丙炔与丙炔发生复分解反应的化学方程式:
________________________________。
(3)烯烃复分解反应可以合成其他反应难以合成的物质,写出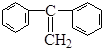 制取
制取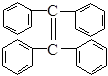 的化学方程式:________________________________________。
的化学方程式:________________________________________。
(4)人们在上世纪50年代已发现了烯烃复分解反应,到了70年代由伊夫•肖万揭示了反应机理,并制得了钛、钨、钼等金属卡宾。烯烃复分解反应有着广阔的应用前景。则后两位化学家所作的贡献应是___________(填序号,多项选择)。
(a)找到了更价廉的金属卡宾
(b)找到了在更多化学环境都有催化活性的金属卡宾
(c)使反应原理转化为实际应用
已知碳原子数小于或等于8的单烯烃与HBr反应,其加成产物只有一种结构。
(1)符合此条件的单烯烃有种,判断的依据是
;
(2)在这些单烯烃中,若与氢气加成后,所得烷烃的一氯代物的同分异构体有三种。这样的单烯烃的结构简式为。
某学生有0.1000mol/L KOH溶液滴定未知尝试的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______________。
用中和滴定的方法测定NaOH和Na2CO3的混含液中的NaOH含量时,可先在混合液中加过量BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示)
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,___________(填“会”或“不会”)使BaCO3溶解而影响测定NaOH的含量,理由是________________。
(2)确定终点时溶液的颜色由___________变为_____________。
(3)滴定时,若滴定这中滴定液一直下降到活塞处才到达滴定终点,_________(填“能”或“不能”)由此得出准确的测定结果。
(4)___________(填“能”或“不能”)改用甲基橙作指示剂。若使用甲基橙作指示剂,则测定结果_____________(填“偏高”、“偏低”或“正确”)。
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是___________________mL。(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)______________。
| A.是amL |
| B.是(50-a)mL |
| C.一定大于amL |
| D.一定大于(50-a)mL |