磷是重要的非金属元素。
28.有关的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.25℃时,HF的Ki =" 3.6×10" – 4 ;H3PO4的Ki1=" 7.5×10" -3,Ki2=" 6.2×10" -8,Ki3=" 2.2×10" -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
常温下,某未知酸性溶液中,可能含有大量的Cl-、OH-、CO32-、H+、Ag+、Fe3+ 等离子。你认为其中一定含有的离子是,一定不含有的离子是,还需进一步检验的离子是,为了进一步确认是否含该子,需要的试剂和现象。
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
(1)若A为淡黄色固体,D为强酸,则D为(填写化学式) 。写出B→C转化的化学方程式
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。则A为 ,写出A→B转化的化学方程式:
燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是
(2)在煤中加适量生石灰,使SO2与石灰反应,化学方程式为,
该生成物仍可被氧化而成稳定的化合物,化学方程式为。
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: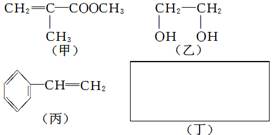
已知:① CH3CH=CH2OH →CH3CH2CHO
②CH3C(OH)=CH2→CH3COCH3
③乙醛在一定条件下能够被溴水氧化。
填写下列空白:
(1)甲中不含氧原子的官能团是__________;下列试剂能与甲反应而褪色的是________(填标号)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液 d.滴加酚酞的氢氧化钠溶液
(2) 淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉稀硝酸△AB浓硫酸170 ℃CDNaOH溶液△乙
B的分子式是__________,试剂X可以是__________。
(3)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________________。甲的另一种同分异构体A。①A能发生银镜反应,②A在酸性条件下的水解产物都能使溴水褪色。A可能的结构有种。
(4)已知: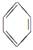 +RCl
+RCl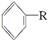 +HCl(—R为烃基)
+HCl(—R为烃基)
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是_______________________________________________________________。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现紫色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为__________________。
甲苯和溴乙烷混合物可通过如下流程进行分离。
请填写下列空白:
⑴试剂A的名称为;X的结构简式为;
⑵在甲苯与溴乙烷的混合物中加入试剂A后的常用主要实验分离仪器是;
操作①是;
⑶写出在甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式:。