Cl2是一种重要的化工原料,下图是一些含氯产品。

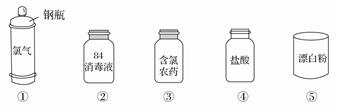
(1)①中钢瓶上应贴的标签为_____________。
A.腐蚀品 B.爆炸品 C.有毒品 D.易燃品
(2)下列有关漂白粉和漂白液的说法正确的是___________。
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉
D. 漂白液的有效成分是Na2O2
(3)工业上利用Cl2制盐酸,其化学方程式为____________________________。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是_____________。
A.硝酸银溶液 B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
(4)将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是_________L;被氧化的HCl的质量是_____________g。
(5)下图是实验室用KMnO4与浓盐酸制取适量氯气的简易装置。
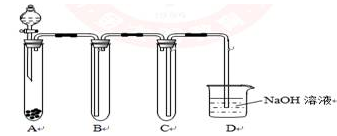
装置B、C、D的作用分别是:
B___________________________________________________;
C___________________________________________________; D___________________________________________________。
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题: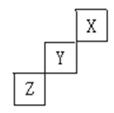
(1)X元素形成单质的分子式是__________;
(2)写出Y元素形成的单质跟水反应的化学方程式:____________;
(3)写出单质Z与钠反应的化学方程式:_________________。
A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A、B、C、D的名称分别是________、________、______、________。
(2)A的离子结构示意图是_______,C的原子结构示意图是________。
A.A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空: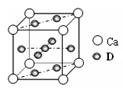
(1)A、B、C的第一电离能由小到大的顺序为。
(2)A的最高价氧化物对应的水化物分子中其中心原子采取杂化。
(3)与A、B形成的阴离子(AB—)互为等电子体的分子有。
(4)基态D原子的核外电子排布式为,右图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为。
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:。
煤制油是一项新兴的、科技含量较高的煤化工技术,发展煤制油对我国而言具有重大意义。下列是煤通过间接液化技术制汽油和丙烯的主要工艺流程图。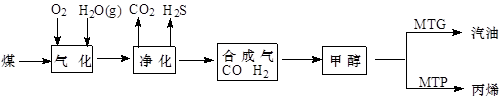
已知甲醇制烃的反应原理为: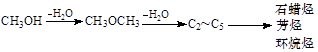
(1)为了提高原料利用率,上述工艺中应控制合成气中V(CO):V(H2)= 。
(2)由二甲醚在催化剂作用下转化为丙烯的化学方程式为:。
(3)每生产1t甲醇约耗煤1.5t,每生产1 t汽油约需耗2.4t甲醇,2015年我国煤制油将达到1000万吨,则2015年当年需消耗原煤约万吨。
(4)采用MTG法生产的汽油中,均四甲苯(1,2,4,5-四甲基苯)质量分数约占4 %~7%,均四甲苯的结构简式为:。
(5)采用DMTO技术,若获得乙烯和丙烯及丁烯3种烃,生成丁烯的选择性(转化丁烯的甲醇的物质的量与甲醇总物质的量之比)为20%,其余生成乙烯和丙烯,设丙烯的选择性为x,今有403.2L(标准状况)合成气,且完全转化为甲醇,甲醇转化为烯烃的总转化率亦为100%,请作出丙烯的物质的量随x变化的曲线。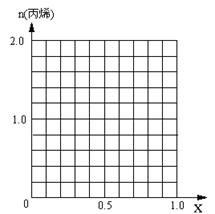
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下: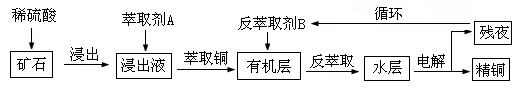
已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:。
(2)写出用惰性电极电解水层的电解总反应方程式:。
(3)循环中反萃取剂B的主要成分是。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol•L—1H2SO4溶液浸取后,还需加入10mL 1.0mol•L—1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?