下列反应中,属于加成反应的是
A.CH3COOCH2CH3 + H2O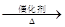 CH3CH2OH + CH3COOH CH3CH2OH + CH3COOH |
B.CH2=CH2+HCl CH3CH2Cl CH3CH2Cl |
C.2CH3CH2OH+O2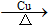 2CH3CHO +2H2O 2CH3CHO +2H2O |
D.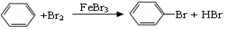 |
下列实验或现象能证明某硫酸铝溶液中含的杂质一定为Fe3+的是
| A.加入足量氢氧化钠溶液后产生的浑浊不溶解 |
| B.用pH试纸检验呈弱酸性 |
| C.滴入KSCN溶液后溶液变血红色 |
| D.溶液显浅黄色 |
升高温度,下列数据不一定增大的是
A.化学反应速率 |
B.弱酸的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
室温下,pH均为12的两种溶液:①氨水.②氢氧化钠溶液。下列说法不正确的是
| A.两溶液中c(OH-):①=② |
| B.两溶液的物质的量浓度:①=② |
| C.两溶液分别加水稀释10倍,稀释后溶液的pH:①>② |
| D.等体积的两溶液分别与同浓度的盐酸完全中和,消耗盐酸的体积:①>② |
将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是
| A.③④ | B.②③⑥ | C.①⑥ | D.②④ |
下列离子方程式中,属于水解反应的是
A.HCOOH + H2O HCOO-+ H3O+ HCOO-+ H3O+ |
B.CO2 + H2O HCO3- + H+ HCO3- + H+ |
C.CO32- + H2O HCO3- + OH- HCO3- + OH- |
D.HS-+ H2O S2-+ H3O+ S2-+ H3O+ |