26.(10分)孔雀石的主要成分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下: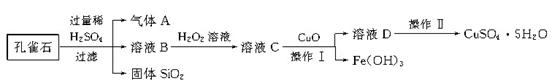
请回答下列问题:
(1)溶液B中的金属离子有Cu2+、Fe2+、Fe3+。若要检验溶液B中Fe2+,最适宜选用的试剂为________(填字母)。
a.KMnO4溶液 b.铁粉 c.NaCl溶液 d.KSCN溶液
(2)向溶液B中加入H2O2溶液的目的是将溶液中的Fe2+氧化为Fe3+,写出该反应的离子方程式:____________________________;实验室选用H2O2而不用Cl2作氧化剂,除考虑环保因素外,另一原因是________________________。
(3)由溶液D获得CuSO4·5H2O,需要经过加热蒸发,________,过滤等操作。除烧杯、漏斗外,过滤操作还用到了另一玻璃仪器,该仪器在此操作中的主要作用是____。
(4)将制得的胆矾样品用热重仪进行热重分析,热重仪原理及热重计录如下:
写出212~250 ℃温度范围内发生反应的化学方程式:________________________。
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验: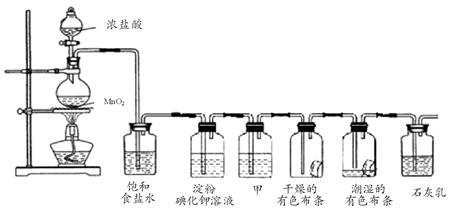
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是,反应的离子方程式为。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2L。
用下图所示装置进行中和热测定实验,请回答下列问题: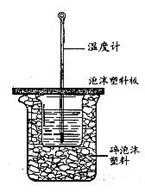
(1)大小烧杯之间填满碎泡沫塑料除了起支撑作用外,还有的作用是,从实验装置上看,图中缺少的一种玻璃仪器是。
(2)使用补全仪器后的装置进行实验,取50mL0.25mol·L-1的H2SO4溶液与50mL0.55 mol·L-1 NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.2J·g-1·℃-1,溶液的密度均为1g·cm-3,忽略溶液混合后的体积变化。通过计算可得中和热△H=KJ·mol-1(保留2位小数), H2SO4与NaOH反应的热化学方程式。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:
ΔH1ΔH(填“<”、“>”或“=”),理由是。
(10分)某化学兴趣小组进行铁跟水蒸气反应的实验,实验装置如下,发现有黑色晶体生成并产生无色气体,他们继续对反应产物进行探究。
已知:①FeO + 2H+= Fe2+ + H2O
②Fe2O3 + 6H+ = 2Fe3+ +3 H2O
③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)该组同学欲确定反应一段时间后试管中固体的成分,设计如下实验方案:
①待试管冷却后,取少许其中的固体溶于稀硫酸得溶液B。
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明试管中固体物质的成分是(只有一个选项符合题意),若溶液未变红色,则说明试管中固体物质的成分是(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(2)该组同学取少量溶液B进行了实验,结果②中溶液未变红色,原因是(用离子方程式表示)。
(3)铁跟水蒸气反应的化学方程为。
(4)该组同学另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出沉淀由白色变成灰绿色最后变成红褐色的反应方程式。
(5)一段时间后,该组同学发现(2)中未变红色的溶液变成红色,说明Fe2+具有(填化学性质)。由此可知,实验室中含Fe2+的盐溶液需现用现配,并且配制含Fe2+的盐溶液时应加入少量。
(10分)已知草酸晶体( )可溶于水,并可与酸性高锰酸钾溶液完全反应:
)可溶于水,并可与酸性高锰酸钾溶液完全反应:
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定 |
第二次滴定 |
第三次滴定 |
|
| 待测溶液体积(mL) |
25.00 |
25.00 |
25.00 |
| 标准溶液体积(mL) |
9.99 |
10.01 |
10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是。
(4)根据上述数据计算X=。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值;
②若KMnO4标准溶液浓度偏低,则X值。
某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:;
(2)A装置中品红溶液颜色(填“褪色”或“不褪色”),证明含有气体;
(3)装置B的作用是除去某种气体,这主要是利用了该气体的性质来实现目的;
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义。你认为应该在B、C装置之间连接下图中的
装置,以确认SO2是否除尽;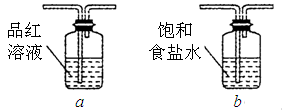
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是_________,二氧化碳造成的环境影响主要是_______。(每空格只填一个选项)
A.酸雨B.破坏臭氧层C.温室效应D.光化学烟雾