欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.29 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
1.00 |
27.31 |
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后 再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)右侧试管中的盛放的是,导气管的下端不能插入液面以下,其目的是。
(2)写出实验室制取乙酸乙酯的化学反应方程式,该反应的类型是。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
由A、B、C、D四种金属按下表中装置进行实验,已知用C与B相连作电极放入硫酸铜溶液中B溶解。根据实验现象填表:
| 装置 |
 |
 |
 |
| 现象 |
金属A断溶解 |
C的质量增加 |
A上有气体产生 |
| 正极反应式 |
|||
| 四种金属活动性有强到弱的顺序: |
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是
。
②哪一段时段的反应速率最小,原因是。
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A 蒸馏水、 B NaCl溶液、 C NaNO3溶液、 D CuSO4溶液、 E Na2CO3溶液,你认为可行的是。(填字母序号)
以下是实验室制取氯气的装置,在图中饱和食盐水的作用是_____________,
浓硫酸的作用是____________________,F中盛放的溶液是__________________________,
起的作用是_____________________________。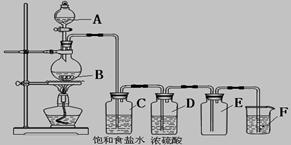
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
| 实验要求 |
化学试剂 |
| 1.检验酒精中是否有水 |
|
| 2.区别CH4和C2H4两种无色气体 |
|
| 3.验证味精是否有食盐 |
|
| 4.除去Fe2O3中的Al2O3 |
供选择的化学试剂:
A.酸性高锰酸钾B.硝酸银溶液和硝酸C.氢氧化钠溶液D.无水硫酸铜粉末