(8分)某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
在周期表主族元素中,甲元素与乙、丙、丁三元 素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20个。据此可以判断:
素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20个。据此可以判断:
(1)甲为元素,丙为元素;
(2)元素乙和丁所形成化合物的分子式为或。
有下列四种微粒:① 、②
、②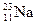 、③
、③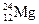 、④
、④ 。用①、②、③、④回答:
。用①、②、③、④回答:
(1)按原子半径由大到小顺序排列的是,
(2) 微粒中质子数小于中子数的是,
微粒中质子数小于中子数的是,
(3)在化合物中呈现的化合价的数值最高的是,
(4)能形成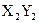 型化合物的是。
型化合物的是。
某元素位于第三周期,第ⅦA 族,它是元素,与K相邻的同族元素的原子序数是和。
以下是 依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是。
(2)F组中物质除了Cl2外还有(填化学式)
(3)D组中的氨水呈弱碱性,用电离方程式表示呈弱碱性的原因:。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中物质E是气体丙的水溶液,物质H是红褐色沉淀。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。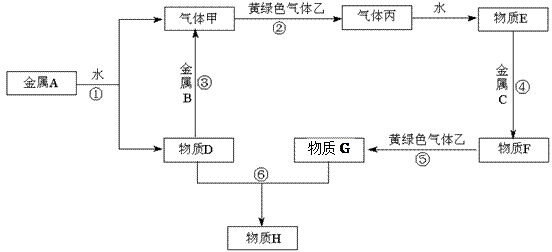
请根据以上信息回答下列问题:
⑴写出A、C、丙的化学式:
A、 C、丙
⑵写出反应③的化学方程式:,
反应⑤的离子方程式:。