(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题: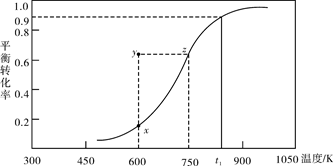
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度
T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程式为 。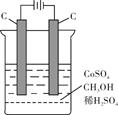
(1)肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g)。
已知:N2(g)+2O2(g)=N2O4(g) △H=+8.7kJ/mol①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.7kJ/mol②
请写出肼跟N2O4反应的热化学反应方程式:___________________________。
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
①第一步反应是__________(填“放热”或“吸热”),判断依据是_____________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是_________________________。
(3)右表是部分化学键的键能数据:
已知N2(g) +3H2(g)  2NH3(g) 试计算该反应的焓变,ΔH= ______(用含有a、b、c的代数式表示)。
2NH3(g) 试计算该反应的焓变,ΔH= ______(用含有a、b、c的代数式表示)。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。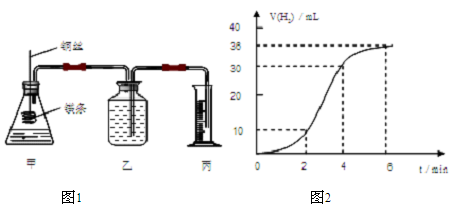
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①计算0~4min内H2的化学反应速率为______________ mL/min。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:_______。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:__________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:___________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中______________________,实验b中______________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(1)有以下几种物质:①食盐晶体 ②铜 ③KNO3溶液 ④熔融的氢氧化钾 ⑤液态氯化氢 ⑥二氧化碳 ⑦酒精。回答以下问题(填序号):
以上物质中能导电的是 ;属于电解质的是 ;
(2)写出下列物质在水中的电离方程式:
H2SO4 ==
KClO3 ==
(1)M(NO3)2的热分解化学方程式为:2M(NO3)2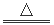 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集2.24L的O2,则M的摩尔质量是
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集2.24L的O2,则M的摩尔质量是
(2)同温同压,等质量的O2和SO2,它们的物质的量之比为_________,密度之比为___________。
(3)标准状况下,3.4g NH3的体积为 L;它与标准状况下 L H2S含有相同数目的氢原子。
硫铁矿【主要成分是二硫化亚铁(FeS2)】是一种重要的化工原料,常用来制备铁、硫酸和氯化铁,其工业流程示意图如图.(资料:Fe+2FeCl3=3FeCl2)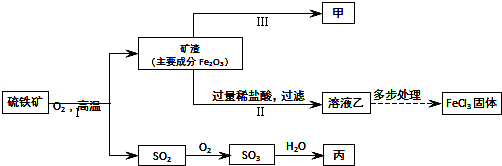
(1)Ⅱ中反应的化学方程式是 .
Ⅲ中反应的化学方程式是 .
(2)结合上述流程,硫铁矿中硫元素的化合价 ,如图出现的含硫元素的物质中,属于氧化物的有 (填化学式).
(3)若向溶液乙和丙的稀溶液中分别加入足量的甲,观察到的现象不同点是