化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是 ;
(2)写出步骤②中产生气体的化学方程式 ;
(3)写出步骤③中的反应现象 ;
(4)滤液C中一定含有的溶质是 可能含有的溶质是 ;
2014年12月28日,郑州地铁1号线投入试运营,不但缓解了市内交通压力,也改善了我市空气质量。
I.地铁站里氧气含量的测定
地铁站里氧气的含量应与地面保持一致。现有一瓶从地铁站里收集到的空气样品,康康利用如图实验装置测定样品中氧气的含量。请指出测定时需要注意的事项。(至少3条)
Ⅱ,铁的冶炼
地铁的修建需要大量的钢材。康康用下图装置模拟炼铁的化学原理,请写出反应的化学方程式: 。为了提高CO的利用率,你将怎样改进此装置?
Ⅲ.金属材料在地铁方面的应用 在地铁修建过程中使用了大量的金属材料
(1)地铁入口处的雨篷骨架用铝合金而不用纯铁的原因是。
(2)钢轨用锰钢的原因是。
(3)出口处的广告架是金属经焊接而成的,焊条的熔点(填“>”、“=”或“<”)组成焊条的纯属金属的熔点。
Ⅳ.金属的活动性
康康到工地了解了部分金属材料的防锈问题。技术人员告诉他,采用镀锌钢管做水管时,最好不要用铜质接头。为了探究这三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。
请回答:
(4)如何判断它们是否发生了化学反应?
(5)甲试管中反应前后溶液的质量(填“增重”、“不变”或“减轻”),乙试管中发生反应的化学方程式为。
(6)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是。
Ⅴ.郑州地铁1号线每车次运送乘客约1800人,走同样的路线,CNG公交车每车次消耗天然气akg(以甲烷计算),每辆CNG公交车运送乘客以60名计。若乘CNG公交车的乘客均改乘地铁1号线,则地铁每运行一车次,可减少二氧化碳排放多少千克?
“用双氧水和二氧化锰制氧气”的反应方程式为_________________________。某同学做了该实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其它实验条件均相同)
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| MnO2粉末用量(克) |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
| 所用时间(秒) |
17 |
8 |
7 |
5 |
4 |
3 |
2 |
2 |
2 |
2 |
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎么样影响的呢?
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其它实验条件也均相同)
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| H2O2溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
20% |
25% |
30% |
| MnO2粉末用量/克 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
| 收集到540mL气体所用时间/秒 |
660 |
220 |
205 |
80 |
25 |
9 |
4 |
3 |
| 反应后溶液温度/℃ |
24 |
34 |
39 |
56 |
65 |
67 |
68 |
70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响?如果有,是怎样影响的呢?
(3)还有那些因素可能影响该反应速率呢?请你说出一个猜想。
小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂.于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣.
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验.
| 序号 |
KClO3的质量 |
其他物质的质量 |
温度 |
氧气的体积 |
反应所需时间 |
| ① |
2.0g |
330℃ |
100mL |
t1 |
|
| ② |
2.0g |
CuO 0.5g |
330℃ |
100mL |
t2 |
| ③ |
2.0g |
MnO2 0.5g |
330℃ |
100mL |
t3 |
| ④ |
2.0g |
MnO2 _________ g |
380℃ |
100mL |
t4 |
(1)若t1 _________ t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率.若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的 _________ 和 _________ 不变.
(2)你认为小雨设计实验③和实验②对比的目的是 _________ .
(3)实验④中MnO2的质量为 _________ g,若t3>t4,则化学反应快慢与温度的关系是 _________ .
(4)写出实验④所涉及的化学方程式 _________ .
某实验小组 利用如图装置测量空气中氧气体积分数并取得成功
【查阅资料】白磷着火点只有40℃.
【提出问题】氧气体积约占空气总体积的多少?
【实验准备】锥形瓶内空气体积为230mL,注射器中水的体积为50mL,该装置气密性良好.
【实验探究】装入药品,按图连好仪器,夹紧弹簧夹.先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出.
【现象分析】
(1)将锥形瓶底部放入热水中,白磷很快被引燃,说明燃烧不能缺少的一个条件是 _________ ,足量的白磷在锥形瓶中未能全部燃烧,说明瓶内剩余气体 _________ (填“支持”或“不支持”)燃烧.写出白磷燃烧的化学方程式 _________ ;
(2)在整个实验过程中,可观察到气球的变化是 _________ ;
(3)待白磷熄灭锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是:①注射器中的水自动喷出来,②当注射器中的水还剩下约4mL时停止下流.导致这些现象发生的原因是 _________ ; _________ .
【得出结论】氧气体积约占空气总体积的 .
.
某校化学研究学习小组的同学在一次活动中查阅资料时发现,单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决的关问题:
【提出问题】
木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
【猜想与假设】
(1)可能是CO。(2)可能是CO2。
【实验准备】
(1)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(2)CO2的检验方法是(用化学方程式表示)___________________。
【设计实验】如下装置图: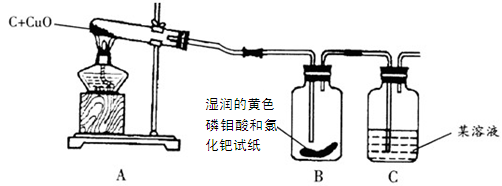
【实验与结论】
| 实验现象 |
实验结论 |
| A中固体由黑色变成红色 |
说明有________________生成 |
| B中黄色试纸没有变蓝 |
说明没有________________生成 |
| C中_________________________ |
说明有CO2生成 |
【反思与评价】
(1) 如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是____________。
(2)假设产生的气体是CO和CO2的混合气体,能否直接用点燃的方法来检验CO2?___(填“能”或“不能”),原因是_______________。