下列反应的离子方程式正确的是
| A.金属镁与稀盐酸反应 :Mg+2H++2Cl-===MgCl2+H2↑ |
B.氯化钡溶液与硫酸反应 :Ba2++ SO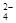 ===BaSO4↓ ===BaSO4↓ |
| C.碳酸钠溶液与盐酸反应 :Na2CO3+2H+===2Na++H2O+CO2↑ |
| D.氢氧化镁与硫酸溶液反应:OH-+H+===H2O |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.氢化物的稳定性:X>Y>Z |
| D.四种元素的常见单质中,Z单质的熔、沸点最高 |
有机化合物的结构可用键线式表示,如CH2=CHCH2Br可表示为 。则有机物
。则有机物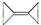 的二氯代物有
的二氯代物有
| A.2种 | B.4种 | C.5种 | D.6种 |
下列离子方程式正确的是
| A.大理石溶于醋酸:CaCO3+2H+= Ca2++CO2↑+H2O |
| B.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+= 2Fe3++2Cl- |
| C.向澄清石灰水中通入少量CO2:OH-+CO2= HCO3- |
| D.酸性氢氧燃料电池的正极反应:H2-2e-= 2H+ |
对于溶液的酸碱性说法正确的是
| A.c(H+)很小的溶液一定呈碱性 |
| B.pH等于7的溶液一定呈中性 |
| C.c(H+)=c(OH-)的溶液一定呈中性 |
| D.不能使酚酞试液变红的溶液一定呈酸性 |
下列叙述正确的是
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D.过量的铜与浓硝酸反应,生成的气体只有NO2 |