图中A-J均为有机化合物,根据图中的信息,回答下列问题: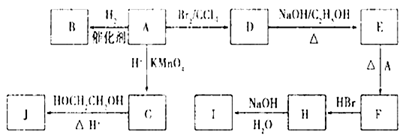
(1)环状化合物A的相对分子质量为82,其中含碳87. 80%,含氢12. 20%。B的一氯代物仅有一种,B的结构简式为 ;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为 ;
(3)由A生成D的反应类型是___________,由D生成E的反应类型是___________;
(4)(3分)G的分子式为C6H10O4,0.146 g G需用20 mL0.100 mol/L NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为:
(5)H中含有的官能团是(名称)________,I中含有的官能团是(名称)___________。
(1)Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。
①写出基态Fe3+的核外电子排布式。
②已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为。
③下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
④F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为。

(2)氨气是一种重要的化工原料。
①液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
为。
②已知:N2(g)+O2(g)=2NO(g)△H=+180kJ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-908 kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式:。
(3)在下图装置中,若通电一段时间后乙装置左侧电极质量增加。
①下列说法错误的是;
| A.乙中左侧电极反应式:Cu2++2e-=Cu |
| B.电解一段时间后,装置丙的pH减小 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为; |
③若Cu电极上质量增加2.16 g, 甲溶液体积为200mL, 则甲溶液的pH=。
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)。 (2)由A、B两种元素以原子个数比5∶1形成离子化合物X,X的电子式为。
(3)由A、B元素形成的化合物B2A4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:。②若E是非金属元素,其单质在电子工业中有重要应用,其氧化物晶体中E原子的杂化方式为。(5)由A、C、D、F四种元素形成的化合物Y(DAFC3)(已知A2FC3的Ka1=1.3×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为;向Y溶液中加入一定量的NaOH,使溶液中c(AFC3-)=c(FC32-),则此时溶液呈(填“酸性”、“碱性”或“中性”);用惰性电极电解Y的水溶液,阳极无气体产生,阳极的电极反应式为。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
| 物质 |
溶解度/(g/100g水) |
||
| 0°C |
40°C |
80°C |
|
| KCl |
28 |
40.1 |
51.3 |
| NaCl |
35.7 |
36.4 |
38 |
| K2Cr2O7 |
4.7 |
26.3 |
73 |
| Na2Cr2O7 |
163 |
215 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_______(用含m、n的代数式表示)。
(6)六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程: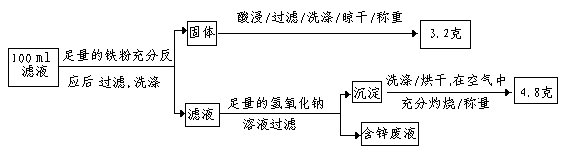
则100ml滤液中Fe2+的浓度为mol·L-1
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=mol。
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率(填“增大”或“减小”或“不变” 下同),H2O的体积分数
(4)温度升至800℃,该反应平衡常数为0.64,则正反应为反应(填“放热”或“吸热”)。