(14分)4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间—甲苯酚为原料的合成反应如下:
实验装置图如下:
主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间—甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪器名称:a 。
(2)简述装置b中将活塞上下部分连通的目的 。
(3)浓H2SO4需要冷却至0℃以下的原因是 。
(4)反应需要搅拌12h,其原因是 。
(5)本次实验产率为 。
(6)实验室制备乙酸乙酯的化学反应方程式 ,用 (填药品名称)收集粗产品,用 (填操作名称)的方法把粗产品分离。
实验室制取少量溴乙烷的装置如右图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。
试管A中的物质分为三层(如图所示),产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏b.氢氧化钠溶液洗涤
c.用四氯化碳萃取d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
【实验】在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol•
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式______________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
【提出假设】假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
【设计实验方案,验证假设】
(3)上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
【分析推理】
(5)铜和稀硝酸反应后溶液为蓝色的原理________________
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。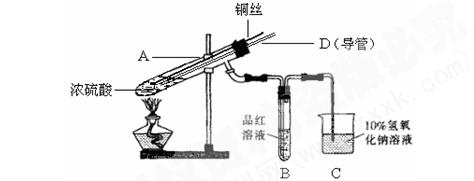
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应,生成Cu2+和铜单质。在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:
(4)②中检验滤渣是否洗涤干净的实验方法是。
(5)③中在煅烧过程中一定发生的反应的化学方程式为。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中若存在Cu2O,也可能有Cu2S |
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、
NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: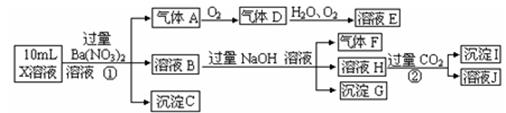
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子(Q)是_________,若要确定该Q(若不止一种,可任选一种)不存在,检验的最可靠的化学方法是_______________________。
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A_______________________。②_____________________________。
(4)假设测定A、F、I均为0.01mol, 10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题: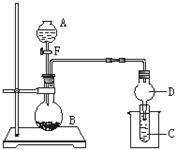
⑴图中D装置在实验中的作用是。
⑵若 A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程为。
⑶若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现是;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的离子反应方程式。
⑷若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是,C中发生反应的离子方程式为。
(5)若B为块状大理石,C为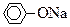 溶液,实验中观察到溶液变浑浊,则酸A不宜用下列的________。
溶液,实验中观察到溶液变浑浊,则酸A不宜用下列的________。
| A.HCl | B.HNO3 | C.H2SO4 | D.CH3COOH |