下图是某化学小组配制50g溶质质量分数为16%的氯化钠溶液的实验操作示意图:
请回答下列问题:
(1)上图所示操作中正确的顺序为_________________________(填序号);步骤B中玻璃棒的作用是___________________________________;
(2)经计算,配制该溶液需要氯化钠的质量为 g;若称量时A出现了右盘偏低的现象,接下来的操作应该是____(填序号)
①调节平衡螺母 ②减少左盘中食盐 ③减少右盘中砝码 ④增加左盘中食盐
(3)配制时应选择 (填写“10”、“50”或“100”)mL量筒量取所需要的水(水的密度是1.0g/cm3);若在量取水时俯视凹液面最低处,其它操作正确,则所得溶液的溶质质量分数为________16%(填“>”、“=”或“<”);
写出下列反应的化学方程式:
(1)铝是活泼金属,生活中的铝锅却有较强的抗腐蚀性,原因是
(2)工业上用一氧化碳还原赤铁矿(主要成分是Fe2O3)炼铁的化学方程式是
(3)为验证某脱氧保鲜剂的主要成分为铁粉,某同学将稀盐酸滴入此脱氧剂中,观察到有气泡生成,并且意外地闻到了一股臭鸡蛋的气味,原来此脱氧剂中除含铁粉外还含有硫化亚铁(FeS),硫化亚铁与稀盐酸发生了复分解反应,有硫化氢气体生成,试写出该反应的化学方程式
根据图一实验现象和图二的甲、乙溶解度曲线回答下列问题: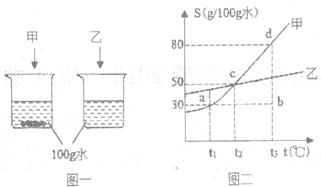
①水具有性,可以作为溶剂使用。
②图二中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是。(填写编号)
③t2℃时,50克水中加入克甲物质,所得溶液恰好饱和。
④90g甲的饱和溶液从t3℃冷却到t2℃点,析出的无水晶体质量是g。
⑤在某温度范围内,将等质量的甲、乙两种固体物质溶解在水中,所得现象如图一所示,则两溶液质量分数甲(填“大于”或“小于”)乙,实验时控制的温度范围是时,均能达到上述现象。
根据下面的溶解度表与溶解度曲线,回答下列问题: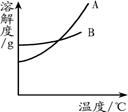
| 温度/°C 溶解度/g |
0 |
20 |
40 |
60 |
80 |
| KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
| NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
(1)氯化钠溶液中的溶剂是。
(2)20℃时,NaCl的溶解度是g。
(3)图中能表示KNO3溶解度曲线的是(填“A”或“B”)。
(4)20℃时,将40g KNO3放入盛有100g水的烧杯中,充分溶解,得到硝酸钾溶液的质量为g,继续加热至80℃,下列各量一定变大的是(填字母序号)。
A.溶质质量 B.溶剂质量 C.溶解度 D.溶质的质量分数
(5)实验室配制500g 10%氯化钠溶液需要氯化钠固体质量g。
下图是某乳业公司纯牛奶包装标签文字说明。
| 纯牛奶 配料:鲜牛奶 保质朗:6个月(4℃) 净含量:250mL/盒 营养成分:(每100mL) 钙≥0.11g 脂肪≥3.3g 蛋白质≥2.9g |
(1)人体缺钙容易患,每盒该纯牛奶中含钙至少g。
(2)该纯牛奶为人体提供的营养物质有蛋白质、无机盐、水和
。
化学用语是学习化学的重要工具。
(1)用化学符号表示:
①2个氧原子;②3个氮分子;③4个二氧化碳分子;
④氢氧根离子;⑤铝离子;⑥氧化铜中铜元素的化合价。
(2)用字母序号填空:
| A.硫酸铜 | B.聚乙烯 | C.干冰 | D.氧化钙 E.氢气 F.碳酸钠 |
①可用于人工降雨的是;②配制波尔多液的一种盐;
③侯德榜制得的碱;④用作食品干燥剂的是;
⑤用于包装食品的是;⑥绿色能源。
(3)写出下列反应的化学方程式:
①红磷在空气中燃烧;
②电解水;
③实验室炼铁原理;
④过氧化钠(Na2O2)与CO2反应生成碳酸钠和氧气。