由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素的化合物D。
(1)列举化合物D的两种用途:_____________。
(2)下列物质的主要成分为C的有_____________(填字母)。
a.沙子 b.水玻璃 c.黏土 d.玛瑙
(3)将C与纯碱混合,高温熔融时也能发生反应生成D,同时还生成B元素的最高价氧化物E;将E通入足量D的水溶液中,又发生反应生成含A元素的化合物F。
①C与纯碱混合高温熔融时发生反应的化学方程式为__________________________。
②E与足量D的水溶液反应的离子方程式为_____________。
在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是__________,只有还原性的是________,既有氧化性又有还原性的是________。
在Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子的作用,使胶体形成了沉淀,这个过程称为_______
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图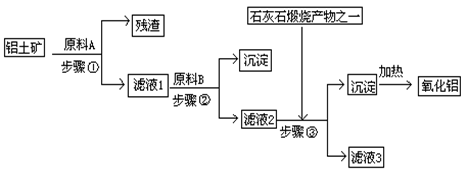
⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响____________________________________________________________。
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3 g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
(2)该结晶水合物的化__________________________________________________.
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5 mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
写出除去下列物质中的杂质(括号内为杂质)时发生反应的化学方程式:
(1)Na2CO3固体(NaHCO3);
(2)SiO2(Al2O3)。