工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①常温下,测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 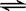 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①H2S气体与足量NaOH溶液反应的化学方程式
②铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向
滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
A的化学式是B的化学式是
(2)原白色粉末中一定含有,可能含有,
对可能含有的物质,可通过(填实验名称)进一步检验。
室温下,单质A 、B、C分别为常见金属、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。
、B、C分别为常见金属、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。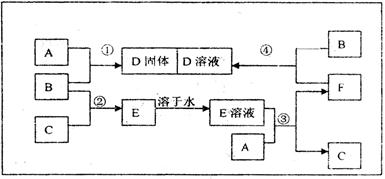
请回答下列问题:
(1)A是B是;(填化学式)
(2)反应①的化学方程式;
(3)反应③的化学方程式;
(4)反应④的化学方程式为;
某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I—、CO32-,取该溶液进行下述实验:
(1)PH试纸检验,该溶液呈强酸性;
(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫红色;
(3)另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。
根据上述现象原溶液肯定存在的离子是————;肯定不存在的离子是—————;可能存在 的离子是——————;
的离子是——————;
漂白粉在 生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)用Cl2和石灰乳制作漂白粉的反应方程式
其成分是有效成分是(填名称)
(2)用Cl2和石灰乳制作漂白粉的目的是()
| A.转变为较HClO稳定且易储运的物质 |
| B.转变为更易溶于水的物质 |
| C.提高氯气原利用率 |
| D.增强漂白能力 |
(3)瓶装漂白粉久置空气中会失效。用化学方程式表示漂白粉在空气中易失效的原因:
①
②
常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后溶液的pH=8的原因是____________________________(用离子方程式表示)。
(2)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列________(填序号)。 |